UPDATE
Im letzten Blog-Beitrag vor unserer Sommerpause geht es passend zum ersten medXevent um das Produktregister im Rahmen des PMCF. Hersteller von Medizinprodukten sind im Rahmen der MDR bei der klinischen Nachbeobachtung (Post-Market Clinical Follow-up, PMCF) dazu verpflichtet, verschiedene allgemeine und besondere Methoden und Verfahren sowie spezifische der klinischen Nachbeobachtung anzuwenden. Eine sehr proaktive Methode zur Gewinnung eigener klinischer Daten aus dem klinischen Routinealltag stellt hier das Register dar. In diesem Blog-Beitrag zeigen wir Ihnen, was ein Register ist und wie Sie es im Rahmen Ihres PMCF für Ihr Medizinprodukt einsetzen können.
Abkürzungen
MDR (medical device regulation; EU-Verordnung 2017/745)
PMCF (Post-Market Clinical Follow-up, klinische Nachbeobachtung)
RCT (Randomized Controlled Trial)
1. Einleitung
Die MDR fordert im Rahmen des PMCF die kontinuierliche Erhebung von klinischen Daten zur klinischen Leistung, zum klinischen Nutzen und zur Sicherheit von Medizinprodukten über den gesamten Produktlebenszyklus hinweg. Ein Register kann hier insbesondere zur Erfassung von Wirksamkeitsdaten bei der routinemäßigen klinischen Anwendung des Produktes eingerichtet und verwendet werden und eignet sich deshalb für die Darstellung der Effektivität im Versorgungsalltag.
Im Rahmen der MDR zählt das Register somit zu den proaktiven Aktivitäten der klinischen Nachbeobachtung (Post-Market Clinical Follow-up, PMCF). Die Auswertung des Registers wird als Überprüfung der Registerdaten bezeichnet, die in der Regel retrospektiv angelegt ist.

Abb. 1 Eingliederung des Registers in den Prozess der Marktüberwachung gemäß MDR (Quelle: General methods and procedures of PMS and PMCF (source: Keene A. Leveraging Post-Market Surveillance and Post-Market Clinical Follow-Up Data to Support EU Medical Device Regulation (MDR) Compliance, Whitepaper)
2. Definition des Registers
2.1 Definition 1
„Ein Register ist eine möglichst aktive, standardisierte Datenerfassung von Beobachtungseinheiten zu vorab festgelegten aber erweiterbaren Fragestellungen, für die ein genauer Bezug zur Quellpopulation transparent darstellbar ist.“
(Quelle: Deutsches Institut für Gefäßmedizinische Gesundheitsforschung)
2.2 Definition 2
”Ein organisiertes System, das Beobachtungsstudienmethoden verwendet, um einheitlicheDaten (klinische und andere) zu sammeln, um bestimmteErgebnisse für eine Population zu bewerten, die durch einebestimmte Krankheit, einen Zustand oder eine Exposition definiert ist, und das einem oder mehreren vorgegebenenwissenschaftlichen, klinischen oder politischen Zweckendient.“
(Quelle: Gliklich RE et al., 2010)
3. Produktregister
Grundsätzlich sind medizinische Register sinnvoll und nützlich, denn Sie generieren notwendige medizinische Versorgungsdaten unter Alltagsbedingungen. Register
- schaffen die Voraussetzung für einen sicheren Medizinbetrieb und für eine kontinuierliche Qualitätsverbesserung,
- schaffen Marktbeobachtungswissen und generieren wichtige Produktinformationen für die Medizinprodukte-Hersteller und Wissen für deren Marktforschung und Neuentwicklungen,
- bieten die Chance eines "Frühwarnsystems", um Auffälligkeiten frühzeitig zu erkennen und Schadenswiederholungen zu vermeiden,
- liefern Antworten auf die Fragen:
- Wo und warum ist der Schaden entstanden?
- Welche Rolle spielen Produkt, Arzt, Patient?
- Wo können wir dazu lernen?
Darüber hinaus können Effekte aus Registerdaten einen Hinweis auf oder Beleg für einen klinischen Nutzen darstellen und sind somit ein wichtiger Beitrag zur klinischen Nachbeobachtung (Post-Market Clinical Follow-up, PMCF).
3.1 Regulatorische Voraussetzung
In Anhang XIV Teil B MDR: Klinische Nachbeobachtung fordert die MDR im Rahmen des PMCF die kontinuierliche Erhebung von klinischen Daten zur klinischen Leistung, zum klinischen Nutzen und zur Sicherheit von Medizinprodukten über den gesamten Produktlebenszyklus hinweg:
„Die klinische Nachbeobachtung nach dem Inverkehrbringen ist als ein fortlaufender Prozess zur Aktualisierung der klinischen Bewertung gemäß Artikel 61 und Teil A dieses Anhangs zu verstehen und wird im Plan des Herstellers zur Überwachung nach dem Inverkehrbringen behandelt. Bei der klinischen Nachbeobachtung nach dem Inverkehrbringen sammelt und bewertet der Hersteller auf proaktive Weise klinische Daten, die aus der Verwendung eines die CE-Kennzeichnung tragenden, im Rahmen seiner Zweckbestimmung gemäß dem einschlägigen Konformitätsbewertungsverfahren in den Verkehr gebrachten oder in Betrieb genommenen Produkts im oder am menschlichen Körper hervorgehen, um die Sicherheit und die Leistung während der erwarteten Lebensdauer des Produkts zu bestätigen, die fortwährende Vertretbarkeit der ermittelten Risiken zu gewährleisten und auf der Grundlage sachdienlicher Belege neu entstehende Risiken zu erkennen.“
(MDR, Anhang XIV Teil B)
3.2 Abgrenzung zu PMCF-Studien
Der gelegentlich verwendete Begriff „Registerstudie“ sollte eigentlich vermieden werden. Studien können ein sehr unterschiedliches Design aufweisen, beinhalten jedoch im Allgemeinen immer die Unveränderlichkeit der gewählten Endpunkte im Studienverlauf und weisen neben einer zeitlichen Begrenzung i. d. R. auch eine quantitative Begrenzung in Bezug auf die Population auf. Außerdem laufen Sie in einem festgelegten Rahmen (Endpunkte, Ein- und Ausschlusskriterien, etc.). Möchte man nun, wie mit einem Register möglich, Daten aus dem klinischen Routinealltag eines Medizinproduktes erheben, können keine Rahmenbedingungen vorherrschen, da dies z. B. eine Erhebung von Off-Label-Use Daten ad absurbum führen würde. Genau das ist aber mit einem Register möglich.
Ein Register erhebt somit uneingeschränkt (d. h. ohne Ein- und Ausschlusskriterien) Daten aus dem klinischen Routinealltag, ohne dabei einer eingeschränkten und definierten Studienstruktur zu folgen.
Eine Registerstudie als nicht-interventionelle Studie bildet somit einen komplementären Ansatz zu einer randomisierten klinischen Studie (RCT).

Tab. 1: Registerstudie versus RCT (Quelle: Novustat, https://novustat.com/statistik-blog/registerstudien-professionell-auswerten-die-essentials.html)
Im Vergleich zum Register werden bei RCT vielfach die mangelnde Repräsentativität des Versorgungsalltags durch eine stark eingeschränkte Population und künstliche Interventionsszenarios kritisiert. Und das zählt natürlich zu den Vorteilen eines Registers, um auch den PMCF-Anforderungen der MDR nachzukommen:
3.3 Vorteile eines Registers
Da Register Daten aus dem klinischen Routinealltag erheben, finden sie nicht in einem strikt regulierten und kontrollierten Rahmen einer PMCF-Studie statt und können so dem Hersteller auch wichtige Einblicke in die tatsächliche Anwendung des Produktes auf dem Markt liefern. Weitere Vorteile sind:
- wissenschaftliche und empirische Evidenz
- valide Darstellung von Verläufen aus der Anwendungsbeobachtung
- alle tatsächlich üblichen Therapieformen und Interventionen werden abgebildet
- keine Patienteneinwilligung erforderlich, nur Datenschutzerklärung und Zustimmung zur Verwendung der Daten

3.4 Datenerhebung mittels Register
Mit einem Produktregister werden zu besonderen klinischen Fragestellungen und ggf. Datenlücken (Parameter) Daten auf völlig anonymisierte Weise sowohl prospektiv als auch retrospektiv erhoben.
Um valide Aussagen treffen zu können, müssen die Register allerdings sorgfältig geplant und implementiert werden. Diese Planung erfolgt über einen Registerplan. Dieser enthält sowohl Vorgaben für die zu erhebenden Parameter als auch deren Auswertung (auch in Bezug auf die Häufigkeit). Darauf basierend wird eine spezifische Registerdatenbank aufgebaut. Die Daten werden in diese möglichst unabhängige Datenbank vollkommen anonymisiert eingetragen und dort zunächst im Hinblick auf Vollständigkeit und Plausibilität validiert. Die Einträge in die Registerdatenbank werden im optimalen Fall von geschulten und ausgebildeten externen Fachkräften validiert. Die Validierung und Überprüfung auf Vollständigkeit und Einhaltung der Ausschlussbedingungen wird von einem Datenmanager überwacht und dokumentiert.
Weiterhin sind GCP und ICH einzuhalten, ebenso wie das Thema Datenschutz. Die Patienten sind mittels Patienteninformation aufzuklären und müssen in die Datenerhebung einwilligen.
Die Daten sollten nicht nur gesammelt, sondern auch statistisch ausgewertet werden. Bei der Auswertung von Registerstudien finden Methoden Anwendung, die für eine Vergleichbarkeit von Patienten oder Patientengruppen sorgen. Dadurch können beispielsweise Matched-Pairs Auswertungen vorgenommen werden. Aber auch Auswertungen anhand des Propensity Scores finden bei Registerstudien Anwendung. Anhand festgelegter Kriterien können dabei zueinander passende Vergleichspartner gefunden werden. Adjustierungsverfahren hinsichtlich unterschiedlicher Ausprägungen z. B. bei Schweregrad einer Krankheit können sinnvoll sein.
(Quelle: Novustat, https://novustat.com/statistik-blog/registerstudien-professionell-auswerten-die-essentials.html. Zugriff am 25.06.2021)
Anwender eines solchen Registers sind auf der einen Seite diejenigen, die in Praxen, Kliniken bzw. bei der Anwendung des Medizinproduktes Daten in die Register-Datenbank eingeben. Weitere Anwender sind Datenmanager, die die Daten statistisch auswerten und aufbereiten. Und natürlich der Hersteller, der diese Daten dann für das PMCF nutzen kann.
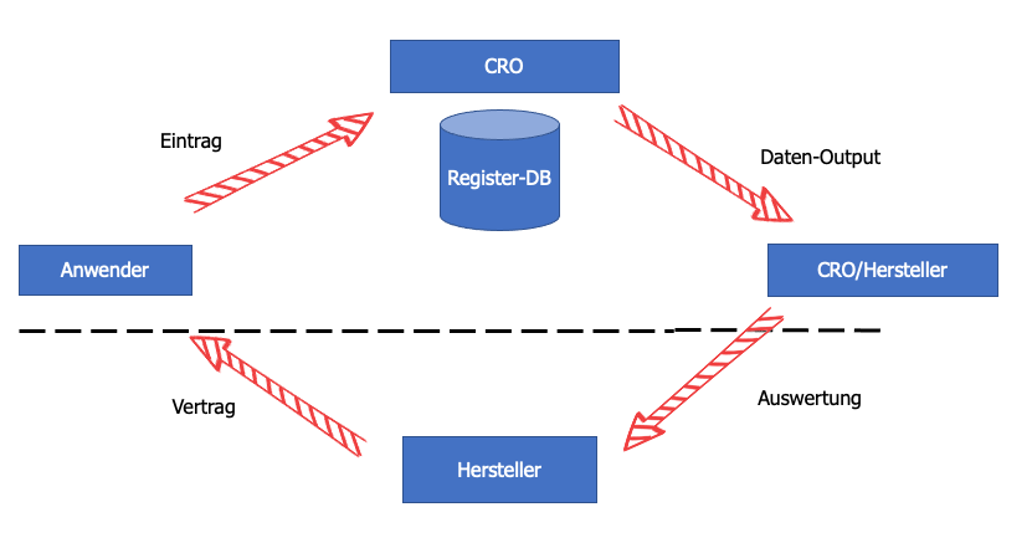
Abb. 3: Kreislauf der Datenerhebung, Auswertung und Nutzung
3.4 Was zeichnet ein gutes Register aus?
Hier kommt es in erster Linie auf die Register-Qualität an:
Wichtig ist die Systematik und Angemessenheit der Datenerhebung im Rahmen des Registers.
Die Validität
- der Stichprobengewinnung,
- der Datenerhebung und
- der statistischen Analysen und Berichte
sind weitere Qualitätsmerkmale. Ebenso weitere übergreifende Qualitätsanforderungen. Dazu zählen:
- Umgang mit limitierenden Rahmenbedingungen
- Akzeptanz bei Meldern und PatientInnen
- Effizienz
- Transparenz und wissenschaftliche Unabhängigkeit
- Flexibilität und Anpassungsfähigkeit
- Aktualität
Auch Standardisierung ist ein wesentlicher Aspekt, wenn über diesen Weg valide und evidente klinische Daten erhoben werden sollen. Dazu zählen beispielsweise:
- die Festlegung von Standards in Verfahrensanweisungen
- die Schulung/ Überprüfung der Datenerhebung/ -erfassung
Register liefern ein nahezu komplettes Bild der Gesamtpopulation und somit Daten aus dem klinischen Routinealltag. Sie haben deshalb folgende Vorteile:
- Darstellung der Effektivität im Versorgungsalltag
- hohe Patientenzahl mit Basisdaten
- heterogene Studienpopulation
- direkter Vergleich zur Nutzenbewertung verschiedener Therapieformen möglich
- mögliche Nutzung als QM-Tool für Benchmarking in Langzeitbeobachtung
- hohe Fallzahlen können erreicht werden
(Quelle: Neugebauer, 2013. Aufbau eines Registers für Register. Institut für Forschung in der Operative Medizin (IFOM))
Anstelle einer PMCF-Studie können Hersteller somit langfristig Daten zu Sicherheit, Leistung und Nutzen zu ihrem spezifischen Produkt im Rahmen der klinischen Nachbeobachtung generieren.
Professionelle Ansätze zur Datenerhebung und Erfassung sorgen für eine hochwertige Datenqualität. Auch in Bezug auf die medizinische Statistik, die Analyse und die Auswahl geeigneter Verfahren ist eine professionelle Unterstützung empfehlenswert.
4. Was wir für Sie tun können
Wir fungieren als wissenschaftliche herstellerunabhängige Institution (CRO). Als solche überlegen wir mit Ihnen zusammen, wie wir bestmöglich ggf. vorhandene Datenlücken im Rahmen des PMCF schließen oder kontinuierlich klinische Daten zu Ihrem Medizinprodukt erheben können.
Eine Möglichkeit stellt hier das Produktregister dar. Dieses wurde außerdem in unserem ersten kostenlosen medXevent am 01.07.2021 detailliert vorgestellt. Hierzu steht nun die Aufzeichnung über unseren YouTube-Kanal zur Verfügung.
Mit diesem ersten Live-Event gehen wir dann Blog- und Event-mäßig in die Sommerpause. Im September ist unser zweites medXevent zum Thema DiGA-Studien geplant. Außerdem erscheint der nächste Blog-Beitrag. In diesem werden wir unsere brandneuen GCP-MDR-Schulungen für Prüfer vorstellen.
5. Wie wir Ihnen helfen können
Ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss, klären wir bei medXteam im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung. Das gilt auch für Ihr Register!
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung
