Die Blogreihe der medXteam GmbH greift nun wie im Ausblick des ersten Beitrags im Oktober beschrieben den ersten Typ der klinischen Prüfungen mit Medizinprodukten auf: Grundlagenforschung – Sonstige klinische Prüfung (MDR Artikel 82).
Sonstige klinische Prüfungen mit Medizinprodukten
1. Einleitung
Grundlagenforschung gibt es nicht erst seit der EU-Verordnung 2017/745 (Medical Device Regulation, MDR), im Gegenteil. Allgemein geht es hier um die Untersuchung der Machbarkeit, um die Klärung grundsätzlicher Fragestellungen. Ziel der Grundlagenforschung ist demnach:
- die Erforschung technischer Grundlagen
- die Erforschung medizinischer Grundlagen
- die Integration in die Entwicklung neuer Produkte
Meist finden solche Aktivitäten im Labor statt:

Abbildung 1: Forschungsvorhaben zur Machbarkeit
Doch es gibt auch immer wieder Fragestellungen, die sich nur anhand von Tests/Untersuchungen am Menschen klären lassen.
Bisher war dieser Fall im MPG nicht geregelt. Dort gibt es mit Medizinprodukten lediglich klinische Prüfungen nach den §§ 20 ff.
Die MDR reguliert dies nun im Artikel 82 mit den sog. „sonstigen klinischen Prüfungen“ (engl. „other clinical investigations“, dessen Umsetzung auf nationaler Ebene in Deutschland über das MPEUAnpG (Medizinprodukte-EU-Anpassungsgesetz) in Kapitel 4, Unterabschnitt 2, § 47 bis § 61 detailliert wird.
2. Begriffsklärung „Medizinprodukt“ und „Prototyp“
Ein Medizinprodukt wird in Artikel 2 der MDR wie folgt definiert:
„Medizinprodukt“ bezeichnet ein Instrument, einen Apparat, ein Gerät, eine Software, ein Implantat, ein Reagenz, ein Material oder einen anderen Gegenstand, das dem Hersteller zufolge für Menschen bestimmt ist und allein oder in Kombination einen oder mehrere der folgenden spezifischen medizinischen Zwecke erfüllen soll:
-
Diagnose, Verhütung, Überwachung, Vorhersage, Prognose, Behandlung oder Linderung von Krankheiten,
-
Diagnose, Überwachung, Behandlung, Linderung von oder Kompensierung von Verletzungen oder Behinderungen,
-
Untersuchung, Ersatz oder Veränderung der Anatomie oder eines physiologischen oder pathologischen Vorgangs oder Zustands,
-
Gewinnung von Informationen durch die In-vitro-Untersuchung von aus dem menschlichen Körper
-
auch aus Organ-, Blut- und Gewebespenden
-
stammenden Proben und dessen bestimmungsgemäße Hauptwirkung im oder am menschlichen Körper weder durch pharmakologische oder immunologische Mittel noch metabolisch erreicht wird, dessen Wirkungsweise aber durch solche Mittel unterstützt werden kann.“
Grundlegend für die Definition eines Produktes als Medizinprodukt ist dabei seine Zweckbestimmung. Dies ist gemäß Artikel 2 Satz 12 der MDR „… die Verwendung, für die ein Produkt entsprechend den Angaben des Herstellers auf der Kennzeichnung, in der Gebrauchsanweisung oder dem Werbe- oder Verkaufsmaterial bzw. den Werbe- oder Verkaufsangaben und seinen Angaben bei der klinischen Bewertung bestimmt ist…“
Die Zweckbestimmung ist als Teil der technischen Dokumentation durch den Hersteller zu formulieren und entscheidend dafür, ob ein Produkt einfach nur ein Produkt ist, oder aber ein Medizinprodukt. Damit ein Medizinprodukt als ein solches deklariert werden kann, muss es die Zweckbestimmung unter normalen Einsatzbedingungen erfüllen können und der oben genannten Definition entsprechen.
Deckt sich die Zweckbestimmung eines Produktes nicht mit der oben genannten Definition und bezieht sie sich nicht auf einen der o. g. Punkte, liegt kein Medizinprodukt vor. In diesem Fall gelten die MDR-Anforderungen an Entwicklung und Erstanwendung nicht.
Was ist ein Medizinprodukt und was nicht?

Tabelle 1: Unterscheidung Medizinprodukt - Produkt
Ein als „Prototyp“ oder „Demonstrator“ bezeichnetes Produkt ist ein medizintechnisches Produkt in einer sehr frühen Entwicklungsphase. Dies bedeutet, "dass es sich um eine erste Testversion eines neuen Gerätes, Verfahrens oder auch Konzeptes handelt, welches noch nie klinisch erprobt wurde. Dementsprechend bestehen keine Erfahrungen hinsichtlich eines medizinischen Nutzens, der Gebrauchstauglichkeit im klinischen Alltag, des Anwendungs-/Verwendungs-Protokolls und möglicher Risiken im Zusammenhang mit der Anwendung".
Eine erste Studie mit einem solchen Prototyp/Demonstrator soll dazu dienen, erste und grundlegende Erfahrungen zu sammeln. Weiterhin soll die Machbarkeit des neuen Konzeptes/Verfahrens gezeigt und Optionen für eine mögliche Entwicklung als Medizinprodukt ermöglicht werden. Die gewonnenen Erkenntnisse und Erfahrungen bilden die Grundlage, auf der gegebenenfalls eine weitere Entwicklung des Prototyps/Demonstrators hin zu einem Medizinprodukt erfolgt. Dieser Entwicklungsprozess nach MDR kann dann noch durch zahlreiche Änderungen des Designs, der Ausstattung, technischen Funktionen und der Konfiguration geprägt sein, um eine hinreichende Gebrauchstauglichkeit und klinische/technische Leistung zu erzielen. Erst ein Produkt, das die an es gestellten Ansprüche bezüglich der Sicherheit und klinischen Leistung erfüllt, kann letztendlich in Verkehr gebracht werden.
3. Klinische Erprobung am Menschen – Bestimmung des zutreffenden Studientyps
3.1 Klinische Prüfung zum Nachweis der Konformität von Produkten (Artikel 62 MDR) oder sonstige klinische Prüfung (Artikel 82 MDR)
Zur Abgrenzung einer klinischen Prüfung (Zulassungsstudie) nach Artikel 62 der MDR von einer Machbarkeitsstudie (sonstige klinische Prüfung) sind zunächst die Ziele der regulatorischen Vorgaben im Rahmen der MDR darzustellen:
„Ausgehend von einem hohen Gesundheitsschutzniveau für Patienten und Anwender soll mit der vorliegenden Verordnung ein reibungslos funktionierender Binnenmarkt für Medizinprodukte unter Berücksichtigung der in diesem Sektor tätigen kleinen und mittleren Unternehmen sichergestellt werden. Außerdem sind in dieser Verordnung hohe Standards für die Qualität und Sicherheit von Medizinprodukten festgelegt, durch die allgemeine Sicherheitsbedenken hinsichtlich dieser Produkte ausgeräumt werden sollen.“
Im Zuge dessen spielt die Bestimmung der Sicherheit und Leistungsfähigkeit eines Medizinproduktes als Voraussetzung für das Inverkehrbringen eine elementare Rolle. Inverkehrbringen „bezeichnet die erstmalige Bereitstellung eines Produkts, mit Ausnahme von Prüfprodukten, auf dem Unionsmarkt…“ (MDR Artikel 2, Satz 28) Einzige Ausnahme bildet die Abgabe des Medizinproduktes zum Zwecke einer klinischen Prüfung.
Für das Inverkehrbringen eines Medizinproduktes muss dieses mit einer CE-Kennzeichnung versehen sein. Das CE-Zeichen zeigt an, dass das Medizinprodukt mit den gesetzlichen Anforderungen übereinstimmt (konform ist) und im Zuge des Bewertungsprozesses die Sicherheit und Leistungsfähigkeit gemäß der Zweckbestimmung unter klinischen Alltagsbedingungen nachgewiesen wurde. Der Nachweis wird durch den Hersteller selbst erbracht und als Konformitätsbewertungsverfahren bezeichnet. Hierbei erfolgt eine klinische Bewertung von klinischen Daten, wobei letztere die Sicherheits- und Leistungsdaten des Produktes sind. Im Gegensatz zum Arzneimittelrecht können diese Daten auch aus der Literatur bezogen werden. Voraussetzung ist, dass die entsprechenden Daten für gleichartige Produkte vorliegen und die Gleichartigkeit mit dem eigenen Medizinprodukt nachgewiesen werden kann. Dieses Vorgehen bezeichnet man auch als Literaturroute.
Ist dies nicht möglich, müssen Leistungs- und Sicherheitsdaten vom Hersteller selbst im Rahmen einer klinischen Prüfung – bisher noch der MPG-Prüfung (§ 20 MPG) oder der klinischen Prüfung zum Nachweis der Konformität von Produkten (Artikel 62 MDR) – generiert werden. Eine MPG-Studie erfolgt gemäß der „Verordnung zur Durchführung von klinischen Prüfungen mit Medizinprodukten“ (MPKPV), welche laut § 1 (1) der Verordnung immer bei der Durchführung klinischer Prüfungen gemäß des MPG anzuwenden ist, deren Ergebnisse zur Durchführung eines Konformitätsbewertungsverfahrens gemäß der Medizinprodukte-Verordnung (MPV) verwendet werden sollen. Nach Inkrafttreten der MDR werden diese Verordnung durch die Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates (MDR) sowie das MPG durch das MPEUAnpG (Medizinprodukte-EU-Anpassungsgesetz) ersetzt. Klinische Prüfungen (Artikel 62 MDR) und sonstige klinische Prüfungen (Artikel 82 MDR) werden dann gemäß den Anforderungen der MDR und den ergänzenden nationalen Bestimmungen des MPEUAnpG geplant und durchgeführt. Auch in der MDR stehen Leistung und Sicherheit des Medizinproduktes bei der klinischen Prüfung nach Artikel 62 im Vordergrund:
„Klinische Prüfung“ bezeichnet eine systematische Untersuchung, bei der ein oder mehrere menschliche Prüfungsteilnehmer einbezogen sind und die zwecks Bewertung der Sicherheit oder Leistung eines Produkts durchgeführt wird.“
Sollte das Ziel eines Forschungsprojektes und einer damit verbundenen klinischen Anwendung nicht darin bestehen, im Rahmen eines Konformitätsbewertungsverfahrens die Leistungsfähigkeit und Sicherheit eines Produkts gemäß derzeit noch MPG (i. V. m. MPKPV) und MDR zu bewerten, sondern die medizinisch/technischen Grundlagen zu erforschen, die später ggf. in die Entwicklung neuer Medizinprodukte einfließen (Erprobung eines Prototypen), liegt auch keine „klinische Prüfung“ im Sinne der Regularien vor. Zwar fehlt sowohl im MPG als auch in der MDD eine präzise Unterscheidung und Abgrenzung, diese liefert aber die seit Mai 2017 publizierte MDR in Artikel 62 und 82:
Artikel 62: Allgemeine Anforderungen an zum Nachweis der Konformität von Produkten durchgeführte klinische Prüfungen
- zur Feststellung und Überprüfung, dass ein Produkt so ausgelegt, hergestellt und verpackt ist, dass es unter normalen Verwendungsbedingungen für einen oder mehrere der in Artikel 2 Nummer 1 aufgelisteten spezifischen Zwecke geeignet ist und die von seinem Herstellerangegebene bezweckte Leistung erbringt;
- zur Feststellung und Überprüfung des von seinem Hersteller angegebenen klinischen Nutzens eines Produkts;
- zur Feststellung und Überprüfung der klinischen Sicherheit des Produkts und zur Bestimmung von bei normalen Verwendungsbedingungen gegebenenfalls auftretenden unerwünschten Nebenwirkungen des Produkts und zur Beurteilung, ob diese im Vergleich zu dem von dem Produkt erbrachten Nutzen vertretbare Risiken darstellen.

Tabelle 2: Ziele und Zeitpunkt klinischer Prüfungen zum Nachweis der Konformität von Produkten
Artikel 82: Anforderungen an sonstige klinische Prüfungen (Grundlagenforschung, in- vivo Machbarkeitsstudien, …)
- Klinische Prüfungen, die nicht zu einem der in Artikel 62 Absatz 1 genannten Zwecke durchgeführt werden, müssen den Bestimmungen des Artikels 62 Absätze 2 und 3, Absatz 4 Buchstaben b, c, d, f, h und l und Absatz 6 genügen.
- Um bei klinischen Prüfungen, die nicht zu einem der in Artikel 62 Absatz 1 genannten Zwecke durchgeführt werden, die Rechte, die Sicherheit, die Würde und das Wohl der Prüfungsteilnehmer zu schützen und die Einhaltung wissenschaftlicher und ethischer Grundsätze zu gewährleisten, legt jeder betroffene Mitgliedstaat für ihn geeignete zusätzliche Anforderungen für diese Prüfungen fest.
Und das mit der MDR in Kraft tretende MPEUAnpG liefert dann auch eine Definition für sonstige klinische Prüfungen unter § 3 Satz 4 Begriffsbestimmungen:
"[...] eine klinische Prüfung, die
-
nicht Teil eines systematischen und geplanten Prozesses zur Produktentwicklung oder der Produktbeobachtung eines gegenwärtigen oder künftigen Herstellers ist,
-
nicht mit dem Ziel durchgeführt wird, die Konformität eines Produktes mit den Anforderungen der Verordnung (EU) 2017/745 nachzuweisen,
-
der Beantwortung wissenschaftlicher oder anderer Fragestellungen dient und
-
außerhalb eines klinischen Entwicklungsplans nach Anhang XIV Teil A Ziffer 1 Buchstabe a der Verordnung (EU) 2017/745 erfolgt."

Tabelle 3: Sonstige klinische Prüfung
Somit ergibt sich das zutreffende Studienformat eindeutig aus der Zielsetzung der klinischen Erprobung und dem Entwicklungsstand des anzuwendenden Produktes.
Wenn also Sicherheits- und Leistungsdaten erhoben werden sollen, die zur Konformitätsbewertung eines vorhandenen Prototyps dienen (d. h. das Produkt muss auch in einem entsprechend ausgereiften Zustand vorliegen), greift der MPG-/MDR- Rechtsrahmen und es muss eine klinische Prüfung gemäß MPKPV/MDR Artikel 62 durchgeführt werden.
Befindet sich das Produkt dagegen als prä-Prototypen noch in einem frühen Forschungsstadium und bedürfen zunächst einmal des Nachweises der Funktionalität und Sinnhaftigkeit des zugrundeliegenden Konzeptes und soll daher eine erste Evidenz zur Wirksamkeit des neuen Verfahrens sowie die Überprüfung der Machbarkeit einer ggf. anschließenden klinischen Interventionsstudie erbracht werden, handelt es sich sinngemäß nicht um eine MPG-Studie (MDR Artikel 62), und eine klinische Anwendung erfolgt auch nicht gemäß der MPKPV. Die dann greifenden Anforderungen sind im folgenden Kapitel „Durchführung einer Machbarkeitsstudie“ beschrieben.
Die sonstige klinische Prüfung wird im Artikel 82 der MDR sowie in Kapitel 4, Unterabschnitt 2, § 47 bis § 61 des MPEUAnpG (Medizinprodukte-EU-Anpassungsgesetz) reguliert.
3.2 Zeitpunkt einer sonstigen klinischen Prüfung
Eine sonstige klinische Prüfung wird immer dann durchgeführt, wenn es nicht um die Bewertung der Leistung und Sicherheit des Medizinproduktes geht. Vielmehr steht die Beantwortung wissenschaftlicher oder anderer Fragestellungen im Fokus und das kann zu allen Zeitpunkten des „Produktlebenszyklus“ der Fall sein, selbst sogar noch vor dem eigentlichen Produkt (s. o. Prototyp, Demonstrator). Somit kann es durchaus auch der Fall sein, dass „die sonstige klinische Prüfung im Rahmen der von der CE-Kennzeichnung umfassten Zweckbestimmung durchgeführt wird“ und somit, ginge es um Leistung/Sicherheit und/oder Nutzen eine PMCF-Studie oder klinische Prüfung in Bezug auf Produkte, die die CE-Kennzeichnung tragen, nach Artikel 74 der MDR wäre.
3.3 Durchführung einer Machbarkeitsstudie
Die sonstige klinische Prüfung gliedert sich in die Erfahrungssammlung durch verschiedene Verfahren für die erweiterte Erkenntniserlangung und Verbesserung spezifischer Methoden ein. Gerade am Anfang solcher Entwicklungen steht beispielsweise die Idee, welche zunächst auf ihre Realisierbarkeit getestet werden muss, was üblicher Weise innerhalb von Tiermodellen (in vivo Studien) geschieht. In einer dieser Erprobungsphasen finden erste Verbesserungen und Anpassungen der ursprünglichen Idee statt, die dann wiederum am Tiermodell erprobt werden. So kann die Realisierungsphase der Idee mehrere Zyklen beinhalten. Der Übergang in eine Machbarkeitsstudie tritt dann auf, wenn Hinweise auftreten, dass die Idee zu einer Verbesserung der medizinischen Versorgung beiträgt (Kohnen, 2011).
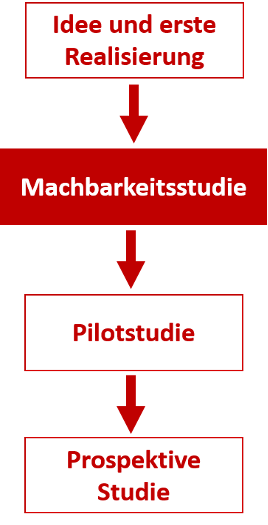
Abbildung 2: Wissensgewinn in der Erfahrungswissenschaft Medizin. (Kohnen, 2011)
Ziel einer solchen sonstigen klinischen Prüfung am Menschen ist das Erbringen erster Evidenz zur Wirksamkeit eines Verfahrens sowie die Überprüfung der Machbarkeit einer möglicherweise anschließenden klinischen Interventionsstudie.
Wenn solche sonstigen klinischen Prüfungen im MPG nicht berücksichtigt waren, so liefert nun die MDR mit Artikel 82 eine klare Definition (siehe oben) und gibt eindeutige Anforderungen an diese Form klinischer Prüfungen:
Die Inbetriebnahme eines Produktes ist kein rechtsfreier Raum, sondern unterliegt umfangreichen Sicherheitsprüfungen (technische Sicherheit, elektrische Sicherheit, biologische Sicherheit und Normenerfüllungsprüfungen), den sogenannten „grundlegenden Anforderungen“ (Anhang I MDD) oder „grundlegenden Sicherheits- und Leistungsanforderungen“ (Anhang I MDR), die durch unabhängige Dritte überprüft werden müssen. Zudem muss eine umfangreiche Risikoanalyse vorgelegt werden und eine ethisch-vertretbare Nutzen-Risiko-Abwägung vorliegen.
Das ergibt sich auch aus Artikel 82 MDR mit Verweis auf Artikel 62 Absatz 4 Buchstabe l:
„(4) Eine klinische Prüfung gemäß Absatz 1 kann nur durchgeführt werden, wenn alle nachfolgenden Bedingungen erfüllt sind: […]
l) das betreffende Prüfprodukt bzw. die betreffenden Prüfprodukte entspricht bzw. entsprechen den grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I mit Ausnahme der Punkte, die Gegenstand der klinischen Prüfung sind; hinsichtlich dieser Punkte wurden alle Vorsichtsmaßnahmen zum Schutz der Gesundheit und der Sicherheit der Prüfungsteilnehmer getroffen. Dies umfasst gegebenenfalls technische und biologische Sicherheitsprüfungen und eine vorklinische Bewertung sowie Bestimmungen im Bereich der Sicherheit am Arbeitsplatz und der Unfallverhütung unter Berücksichtigung des neuesten Erkenntnisstands.“
Da die sonstigen klinischen Prüfungen Forschungsvorhaben sind, die sich in die medizinische Grundlagenforschung am Menschen eingliedern, greifen außerdem die allgemeinen Gesetzesregelungen und Richtlinien innerhalb der medizinischen Forschung. Das gilt für alle sonstigen klinischen Prüfungen, unabhängig vom Zeitpunkt, zu dem sie durchgeführt werden. Zum Schutz von PatientenInnen, Anwendern und Dritten sind verschiedenste Voraussetzungen zu berücksichtigen. Dazu gehört die
- Deklaration von Helsinki in ihrer aktuellen Fassung.
Somit wird den ethischen Standards der medizinischen Forschung am Menschen Rechnung getragen. Besonders sollte innerhalb des Vorhabens auf folgende Punkte geachtet werden:
- Einholung der Einwilligungserklärung der Patienten
- Schutz von nicht-einwilligungsfähigen Patienten
- Das Wohlergehen der „Versuchsperson“ wird vor das Interesse der Wissenschaft gestellt
- Einholen eines positiven Votums der zuständigen Ethikkommission Dies wurde in der MDR in Artikel 82 folgendermaßen aufgenommen:
„Klinische Prüfungen, die nicht zu einem der in Artikel 62 Absatz 1 genannten Zwecke durchgeführt werden, müssen den Bestimmungen des Artikels 62 Absätze 2 und 3, Absatz 4 Buchstaben b, c, d, f, h und l und Absatz 6 genügen.“
Das bedeutet insbesondere:
Artikel 62 Absatz 3
„Klinische Prüfungen werden so konzipiert und durchgeführt, dass der Schutz der Rechte, der Sicherheit, der Würde und des Wohls der an der Prüfung teilnehmenden Prüfungsteilnehmer gewährleistet ist und Vorrang vor allen sonstigen Interessen hat und die gewonnenen klinischen Daten wissenschaftlich fundiert, zuverlässig und solide sind.
Klinische Prüfungen werden einer wissenschaftlichen und ethischen Überprüfung unter- zogen. Die ethische Überprüfung erfolgt durch eine Ethik-Kommission gemäß dem nationalen Recht. Die Mitgliedstaaten sorgen dafür, dass die Verfahren für die Überprüfung durch die Ethik-Kommissionen mit den Verfahren vereinbar sind, die in dieser Verordnung für die Bewertung des Antrags auf Genehmigung einer klinischen Prüfung festgelegt sind. Mindestens ein Laie wirkt an der ethischen Überprüfung mit.“
Artikel 62 Absatz 4
„Eine klinische Prüfung gemäß Absatz 1 kann nur durchgeführt werden, wenn alle nachfolgenden Bedingungen erfüllt sind: […]
b) eine nach nationalem Recht eingesetzte Ethik-Kommission hat keine ablehnende Stellungnahme in Bezug auf die klinische Prüfung abgegeben, die nach dem nationalen Recht des betreffenden Mitgliedstaats für dessen gesamtes Hoheitsgebiet gültig ist;
c) der Sponsor oder sein rechtlicher Vertreter oder ein Ansprechpartner gemäß Absatz 2 ist in der Union niedergelassen;
d) schutzbedürftige Bevölkerungsgruppen und Prüfungsteilnehmer werden gemäß Artikel 64 bis Artikel 68 angemessen geschützt;
f) der Prüfungsteilnehmer oder — falls der Prüfungsteilnehmer nicht in der Lage ist, eine Einwilligung nach Aufklärung zu erteilen — sein gesetzlicher Vertreter hat eine Einwilligung nach Aufklärung gemäß Artikel 63 erteilt;
h) das Recht des Prüfungsteilnehmers auf körperliche und geistige Unversehrtheit, Privatsphäre und Schutz seiner personenbezogenen Daten gemäß der Richtlinie 95/46/EG bleibt gewahrt.“
Es sind darüber hinaus gemäß § 48 des MPEUAnpG die Dokumente gemäß Anhang XV Kapitel II der MDR zu erstellen und bei der Ethikkommission einzureichen.
Unterabschnitt 2 mit den §§ 47 ff im MPEUAnpG ist dem Thema sonstige klinische Prüfungen (Anforderungen, Verfahren bei der Ethikkommission usw.) gewidmet und liefert eindeutige nationale Regulierungen hierzu.
Außerdem empfiehlt es sich, die Anwendung der ISO 14155 für die einheitliche Durchführung einer Studie mit Medizinprodukten zu berücksichtigen. Zwar zielt die Norm auf klinische Prüfungen von Medizinprodukten ab und entspricht damit nicht der Intention einer Machbarkeitsstudie, jedoch können viele Inhalte aufgrund ihrer Sinnhaftigkeit trotzdem angewandt werden. Innerhalb der Norm haben ethische Grundsätze eine vorrangige Stellung und das Kapitel 4 ist den „Ethischen Erwägungen“ gewidmet. Da es gilt, die Sicherheit und das Wohl des Studienteilnehmers im Einklang mit der Deklaration von Helsinki zu schützen (Probandenversicherung, ergänzende gesundheitliche Betreuung), liefert die Norm diesbezüglich eine gute weitere Hilfestellung.
Weiterhin spielen die Nutzen-Risiko-Abschätzung sowie die Rechtfertigung einer „klinischen Prüfung“ eine wesentliche Rolle. Gemäß MDR und MPEUAnpG sind ethische und sicherheitsrelevante Anforderungen als verbindlich anzusehen.
Zu diesem Zweck setzt die ISO 14155 auch die Begriffe „Klinischer Versuch“ und „Klinische Studie“ gleich mit dem der „Klinischen Prüfung“. Zur Rechtfertigung einer klinischen MPG-Prüfung muss eine objektive Widergabe von veröffentlichten und unveröffentlichten Daten sowie eine detaillierte Risiko-Analyse und Nutzen-Risiko- Bewertung erfolgen. Die Rechtfertigung für eine klinische Prüfung findet sich im Prüfplan wieder und dient als Bewertungskriterium für die Ethikkommission in deren Prüfung auf zustimmende Bewertung. Dies gilt gleichermaßen für sonstige klinische Prüfungen, wobei hier aufgrund der frühen Phase und der nicht vorhandenen klinischen Erfahrung lediglich von einer Nutzen-Risiko-Abwägung im Hinblick auf das Forschungsprojekt gesprochen werden kann.
4. Ausblick
Die Blog-Reihe zu den Typen klinischer Prüfungen wird im Dezember durch unser „Weihnachtsspezial“ unterbrochen. Hiermit möchten wir Sie umfassend über die wichtigen Änderungen in Bezug auf klinische Prüfungen durch die MDR noch dieses Jahr informieren, damit Sie für 2021 gewappnet sind.
Das Besondere an unserer Aktion ist dabei, dass der Beitrag bis Weihnachten wächst. Jede Woche kommen neue Abschnitte mit weiteren Änderungen dazu.
Im Januar wird es dann mit dem Thema DiGA-Studien weitergehen.
5. Wie wir Ihnen helfen können
Ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss, klären wir bei medXteam im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung
