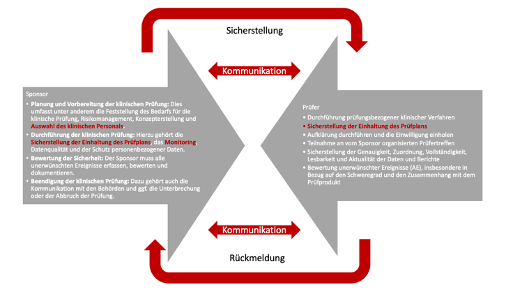
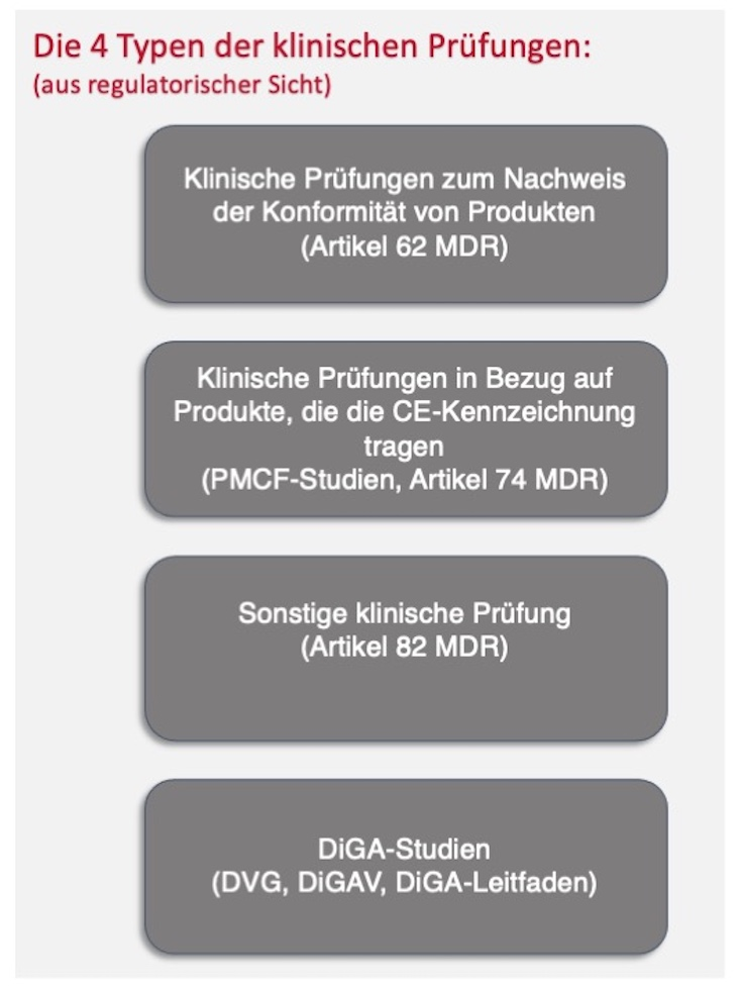
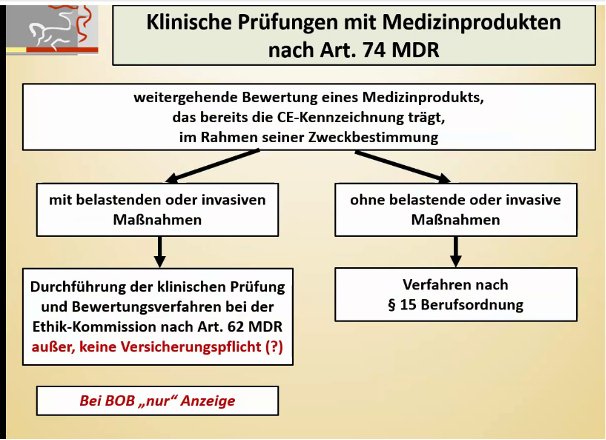
Bei medXteam stehen klinische Daten im Mittelpunkt. In diesem Kontext führen wir als CRO nicht nur klinische Prüfungen mit Medizinprodukten gemäß MDR und ISO 14155 durch, sondern bieten auch sämtliche weiteren Möglichkeiten und Formen der Datenerhebung an. Dieses Mal geht es in diesem Kontext um das Thema der DiGA. Auch hier werden Daten erhoben. Doch dieses Mal steht die Frage im Mittelpunkt: Warum halten sich die Ärzte mit der Verschreibung von DiGAs zurück? Beim folgenden Blog-Beitrag hat aktiv Dr. med. Gisela Knopf mitgewirkt. Sie hat als Allgemeinärztin bereits vielfache Erfahrungen in diesem Bereich gemacht.
Seit Oktober 2023 wird auch immer der Blog-Beitrag des Vormonats als Podcast (medXteam Kompakt) veröffentlicht. Dieser Beitrag erscheint als Interview mit Dr. med. Gisela Knopf dann im Dezember 2023 als Podcast.
Abkürzungen
DiGA Digitale Gesundheitsanwendung
KV Kassenärztliche Vereinigung
Zugrundeliegende Regularien
Digitale-Versorgung-Gesetz (DVG)
Digitale Gesundheitsanwendungen-Verordnung (DiGAV)
DiGA-Leitfaden
1. Einleitung
Als digitale Anwendungen im Gesundheitswesen haben DiGAs (Digital Health Applications) in den letzten Jahren an Bedeutung gewonnen. Sie können dazu beitragen, die medizinische Versorgung zu verbessern und den Zugang zu Gesundheitsdienstleistungen zu erleichtern. Sie bieten Patienten die Möglichkeit, ihre Gesundheit zu überwachen und Krankheiten zu managen, während Ärzte wertvolle Daten erhalten, um bessere Entscheidungen zu treffen.
Trotzdem scheinen viele Ärzte zögerlich zu sein, DiGAs zu rezeptieren. In diesem Beitrag werden diese Situation und die Perspektiven von Ärzten und Krankenversicherungen beleuchtet. Außerdem werden die Gründe für diese Zurückhaltung untersucht und Möglichkeiten aufgezeigt, wie Ärzte dazu ermutigt werden können, DiGAs zu rezeptieren.
2. Einführung in die DiGAs
DiGAs sind medizinische Anwendungen, die von den Krankenkassen erstattet werden und von Ärzten zu Lasten der Krankenkassen rezeptiert werden können. Sie sollen die medizinische Versorgung verbessern, indem sie z.B. bei der Diagnose von Krankheiten helfen oder die Überwachung von Patienten unterstützen. DiGAs können beispielsweise bei der Behandlung von Diabetes, psychischen Erkrankungen oder zur Raucherentwöhnung eingesetzt werden. Die Anwendungen sind in der Regel einfach zu bedienen und können auf Smartphones oder Tablets heruntergeladen werden.
3. Fallstudien erfolgreicher Implementierung von DiGAs
DiGAs haben in den letzten Jahren an Bedeutung gewonnen. Sie umfassen eine Vielzahl von Anwendungen, von Fitness-Trackern bis hin zu spezialisierten Gesundheits-Apps. Viele dieser Anwendungen wurden von medizinischen Fachleuten entwickelt und bieten evidenzbasierte Lösungen zur Verbesserung der Gesundheit. Trotzdem werden DiGAs oft nicht rezeptiert oder genutzt.
Ein Grund für dieses Problem liegt in der fehlenden Sensibilisierung und Schulung von Ärzten. Viele Ärzte sind sich entweder nicht bewusst, dass DiGAs als medizinische Hilfsmittel zugelassen sind, oder sie kennen die Vorteile und Einsatzmöglichkeiten nicht ausreichend. Das führt dazu, dass sie DiGAs nicht rezeptieren oder nur zögerlich empfehlen.
Es gibt bereits einige erfolgreiche Beispiele für die Implementierung von DiGAs in der medizinischen Versorgung. Ein Beispiel ist die Rezeptierung von DiGAs zur Behandlung von Diabetes. Hier können Anwendungen zur Überwachung von Blutzuckerwerten und zur Unterstützung der Selbstverwaltung der Krankheit eingesetzt werden. Ein weiteres Beispiel ist die Verwendung von DiGAs zur Behandlung von Angststörungen und Depression. Hier können entsprechende Anwendungen zur Unterstützung der psychotherapeutischen Behandlung eingesetzt werden.
4. Verschreibung von DiGAs
Ärzte haben verschiedene Bedenken und Herausforderungen, wenn es um die Rezeptierung von DiGAs geht. Einerseits sind sie besorgt über die Qualität und Wirksamkeit der Anwendungen. Sie möchten sicher sein, dass die DiGAs evidenzbasiert sind und den Patienten tatsächlich helfen. Andererseits haben Ärzte begrenzte Zeit während des Patientengesprächs und möchten nicht zu viele verschiedene Anwendungen empfehlen oder verschreiben müssen.
Um diese Herausforderungen zu bewältigen, ist eine bessere Schulung und Aufklärung von Ärzten erforderlich. Sie müssen über die neuesten Entwicklungen im Bereich der DiGAs informiert werden und lernen, wie sie diese effektiv in ihre Praxis integrieren können. Darüber hinaus sollten Kriterien und Leitlinien entwickelt werden, um die Qualität und Wirksamkeit von DiGAs zu gewährleisten bzw. idealerweise sollten die DIGAs Einzug in die bestehenden Leitlinien integriert werden.
4.1 Die Rolle des Arztes bei der Verschreibung von DiGAs
Die Verschreibung von DiGAs liegt in der Verantwortung der Ärzte. Sie müssen entscheiden, welche Anwendungen am besten für ihre Patienten geeignet sind, welche Vorteile sie bieten können und ob diese kostengünstig sind. Ärzte müssen auch sicherstellen, dass die Anwendungen sicher und wirksam sind und dass sie von den Krankenkassen finanziert werden. Dies erfordert ein gewisses Maß an Fachwissen und Erfahrung in Bezug auf DiGAs.
Ärzte und Psychotherapeuten können ein Rezept (Muster 16) für eine DiGA ausstellen, wenn die Verordnung medizinisch geboten ist. Dabei ist immer auch die Wirtschaftlichkeit zu beachten.
Das Wirtschaftlichkeitsprinzip gilt auch für Apps: Auch bei der DiGA-Verordnung ist das Wirtschaftlichkeitsgebot zu beachten, wonach die Leistung ausreichend, zweckmäßig und wirtschaftlich sein muss (§ 12 SGB V).
(Quelle: Apps auf Rezept, Zugriff am 03.11.2023)
4.2. Faktoren, die zur Zurückhaltung von Ärzten bei der Verschreibung von DiGAs beitragen
Trotz der Vorteile von DiGAs sind viele Ärzte zögerlich, diese zu verschreiben. Ein Grund dafür ist, dass sie sich nicht sicher sind, ob DiGAs tatsächlich wirksam sind. Es gibt auch Bedenken hinsichtlich der Sicherheit von DiGAs und der Datensicherheit. Ein weiterer Faktor ist der Mangel an Zeit und Ressourcen, um Patienten in der Verwendung von DiGAs zu unterstützen. Darüber hinaus sind viele Ärzte besorgt über die zusätzliche Belastung durch die Verschreibung und Überwachung von DiGAs. Und nicht zuletzt die Sorge, ob die Kostenübernahme durch die Krankenkassen wirklich gesichert ist oder ob ein entsprechendes Rezept zu einem Regress führen kann.
Hinzu kommt das ohnehin sehr komplizierte Abrechnungs- und Verordnungssystem der Kassenärzte. Insbesondere mit dem ständig schwebenden Damoklesschwert der Regressgefahr (siehe dazu auch der folgende Abschnitt). Regress bedeutet, dass ein Arzt, der einen "Fehler“ (nach Vorgaben der KV) in der Verordnung einer Kassenleistung macht, für diese Leistung selbst zur Kasse gebeten werden kann und auch oft tatsächlich wird. Heißt im Falle von DIGAs, dem verordnenden Arzt werden möglicherweise die Kosten von € 300 – 500 persönlich in Rechnung gestellt. Und um eine DIGA-Verordnung korrekt auszuführen, bedarf es einiger von der Kassenärztlichen Vereinigung festgelegter Punkte, die sich auch noch von DIGA zu DIGA unterscheiden. Dazu kommt auch, innerhalb einer DIGA wechseln zu können, wenn diese z. B. von „vorläufig“ zu „dauerhaft“ gewechselt wird. Oder von „vorläufig“ zu „nicht mehr vorhanden in der Liste“. Und wie soll die KV-Vorgabe der „Wirtschaftlichkeit“ eingehalten werden, wenn möglicherweise letztlich die DIGA verglichen wird mit einer Medikation, welche ein paar Cent Tagestherapiekosten aufweist? Was die KV unter Wirtschaftlichkeit versteht, ist leider für den Einzelfall meist nicht näher definiert und die große BlackBox, wenn es um Regressgefahr geht. Dass hierbei immer wieder Äpfel mit Birnen verglichen werden ohne Einflussmöglichkeit der Ärzteschaft ist leider allseits bekannt.
4.3 Auswirkungen von Budgetbeschränkungen auf die Verschreibung von DiGAs
Ein weiterer wichtiger Faktor, der zur Zurückhaltung von Ärzten bei der Verschreibung von DiGAs beitragen kann, sind die sehr speziellen und teils schwer durchschaubaren Abrechnungssysteme der Kassenärzte einschließlich der Budgetbeschränkungen. Die Krankenkassen stellen begrenzte Mittel für die Finanzierung von DiGAs zur Verfügung und so bestehen große Bedenken der Ärzteschaft, ob und unter welchen Bedingungen DIGAs durch die gesetzlichen (und privaten) Krankenkassen erstattet werden. Ärzte stehen unter permanentem Druck, kostengünstig zu arbeiten, kombiniert mit dem allgegenwärtigen Zeitdruck in der Praxis. Allein die Beschäftigung mit der Materie, wann welche DIGA unter welchen Voraussetzungen verordnet werden darf, ist ein hoher zeitlicher Aufwand.
Hinzu kommt das oben bereits erwähnte Damoklesschwert, dass, wenn womöglich eine der vorgegebenen Bedingungen (versehentlich) nicht eingehalten wurde, die Kostenübernahme durch die Krankenkasse bzw. die Kassenärztliche Vereinigung im allgemeinen verweigert wird und dem Arzt die Kosten der DIGA in Form eines Regresses in Rechnung gestellt werden. Dieses Risiko wird umgangen, wenn der Arzt erst gar keine DIGA verordnet bzw. dem Patienten empfiehlt, sich selbst eine entsprechende App zu besorgen.
4.4 Adressierung von Bedenken von Ärzten bezüglich DiGAs
Um Ärzte dazu zu ermutigen, DiGAs zu verschreiben, müssen ihre Bedenken und Sorgen angesprochen werden. Eine Möglichkeit, dies zu tun, ist die Bereitstellung von Schulungen und Fortbildungen, um das Wissen und die Kenntnisse der Ärzte in Bezug auf DiGAs zu verbessern. Es kann auch hilfreich sein, die Vorteile von DiGAs zu betonen, wie z.B. die Verbesserung der Patientenversorgung und die Reduzierung von Kosten. Eine weitere Möglichkeit besteht darin, Ärzten die Möglichkeit zu geben, DiGAs auszuprobieren und sie selbst zu testen, um ihre Wirksamkeit und Sicherheit zu beurteilen.
5. Sicht der Krankenversicherungen
Auch Krankenversicherungen spielen eine wichtige Rolle bei der Verschreibung von DiGAs. Sie müssen sicherstellen, dass die Anwendungen, die sie erstatten, tatsächlich einen Nutzen für die Patienten haben und kosteneffektiv sind. Aus diesem Grund führen sie oft eigene Bewertungen und Studien durch, um die Wirksamkeit von DiGAs zu überprüfen.
Ein weiteres Problem, das Krankenversicherungen haben, ist die Vielzahl von verfügbaren DiGAs. Sie müssen entscheiden, welche Anwendungen sie erstatten und welche nicht. Dies erfordert eine sorgfältige Bewertung und Auswahl, um den Patienten die besten Optionen anzubieten.
6. Überwindung von Hindernissen bei der Verschreibung von DiGAs
Um die Verschreibung von DiGAs zu fördern, müssen Hindernisse für die Einführung und Nutzung von DiGAs überwunden werden. Dazu gehört die Bereitstellung von ausreichenden Ressourcen und Schulungen für Ärzte und Patienten. In Bezug auf die Ärzte müssen hierbei insbesondere auch die Verordnungsmodalitäten geschult werden bzw. besser noch: deutlich vereinfacht werden, was ja dann auch zum Thema Digitalisierung passt.
Es kann auch hilfreich sein, die Zusammenarbeit zwischen Ärzten und Entwicklern von DiGAs zu fördern, um sicherzustellen, dass die Anwendungen den Bedürfnissen der Patienten entsprechen. Darüber hinaus können Krankenkassen für DiGAs sinnvolle Anreize für die Verschreibung von DiGAs schaffen, um die Akzeptanz und Nutzung zu fördern. Seitens der Krankenkassen gibt es diese Anreize bereits, jedoch ist deren Erlangung derart kompliziert und unübersichtlich, dass sich die Relation Gewinn zu Aufwand für die meisten Ärzte nicht lohnt.
6.1 Die Zukunft von DiGAs im Gesundheitswesen
Die Zukunft von DiGAs im Gesundheitswesen ist vielversprechend. Sie können dazu beitragen, die medizinische Versorgung zu verbessern und den Zugang zu Gesundheitsdienstleistungen zu erleichtern. DiGAs können auch dazu beitragen, die Kosten im Gesundheitswesen zu senken, indem sie die Notwendigkeit von teuren medizinischen Folgekosten reduzieren. Es wird erwartet, dass die Nachfrage nach DiGAs in den kommenden Jahren weiter steigen wird, da immer mehr Menschen Zugang zu digitalen Technologien haben.
6.2 Ressourcen für Ärzte, um mehr über DiGAs zu erfahren
Für Ärzte, die mehr über DiGAs erfahren möchten, stehen eine Reihe von Ressourcen zur Verfügung. Dazu gehören Schulungen und Fortbildungen, Fachzeitschriften und Online-Ressourcen. Es kann auch hilfreich sein, sich mit Kollegen auszutauschen, die bereits Erfahrung mit der Verordnung von DiGAs haben. Dies alles steht zwar zur Verfügung, jedoch muss der nötige Aufwand der Informationserlangung überschaubar bleiben, die Verordnung von DIGAs ist letztlich nur ein sehr kleiner Teil des ärztlichen Einsatzgebietes.
7. Schlussfolgerung
DiGAs haben das Potenzial, die medizinische Versorgung zu verbessern und den Zugang zu digitalen Gesundheitsanwendungen für Patienten zu erleichtern.
Es gibt eine Reihe von Gründen für die Zurückhaltung der Ärzte bei der Verordnung, wobei Bedenken hinsichtlich der Wirksamkeit und Sicherheit von DiGAs wahrscheinlich eher gegenüber Regressgefahr und Zeitmangel im Hintergrund stehen.
Insofern zögern Ärzte einfach aus den oben genannten Gründen, eine Therapieform im dreistelligen Preisbereich zu verordnen, was wahrscheinlich den Herstellern so nicht bewusst ist. Dass die Patienten die DIGAs teils auch ohne Verordnung durch den Arzt direkt von der Krankenkasse erhalten können, scheint hier ein guter Ansatz zu sein.
Um die Verordnung von DiGAs zu fördern, müssen Hindernisse überwunden und Ärzte ermutigt werden, sich mit DiGAs vertraut zu machen. Hier sind beispielsweise eine bessere Schulung und Aufklärung von Ärzten sowie klare und vor allem einheitliche Kriterien und Leitlinien für DiGAs erforderlich. Darüber hinaus sollten Krankenversicherungen ggf. ihre Bewertungsprozesse verbessern, um die besten DiGAs auszuwählen.
5. Wie wir Ihnen helfen können
Ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss, klären wir bei medXteam im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Wenn eine klinische Prüfung durchgeführt werden soll, müssen zuvor grundlegende Sicherheits- und Leistungsanforderungen erfüllt sein. Die Daten aus der klinischen Prüfung münden dann in die klinische Bewertung, die wiederum die Basis für Post-Market-Clinical-Follow-up (PMCF)-Aktivitäten (einschließlich einer PMCF-Studie) darstellt.
Außerdem benötigen alle Hersteller von Medizinprodukten ein Qualitätsmanagement system (QMS), auch bei der Entwicklung von Produkten der Klasse I.
Wir unterstützen Sie während Ihres kompletten Vorhabens mit Ihrem Medizinprodukt, beginnend bei einer kostenlosen Erstberatung, Hilfe bei der Einführung eines QM Systems, Studienplanung und Durchführung bis hin zur Technischen Dokumentation - immer mit primärem Bezug auf die klinischen Daten zum Produkt: von Anfang an bis zum Ende.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung