Literatursuche bei Medizinprodukten
Bei medXteam stehen klinische Daten im Mittelpunkt. In diesem Kontext führen wir als CRO nicht nur klinische Prüfungen mit Medizinprodukten gemäß MDR und ISO 14155 durch, sondern bieten auch sämtliche weiteren Möglichkeiten und Formen der Datenerhebung an. Die Literatursuche spielt in diesem Kontext eine wichtige Rolle. Denn sie ist nicht nur in Verbindung mit der klinischen Bewertung bei Medizinprodukten unerlässlich. Wann, wo und warum man die Literatursuche auch in anderen Situationen benötigt, zeigt dieser Blogbeitrag.
Abkürzungen
MDR Medical Device Regulation; EU-Verordnung 2017/745
DiGA Digitale Gesundheitsanwendung
PMCF Post-Market Clinical Follow-up, klinische Nachbeobachtung
QMS Qualitätsmanagementsystem
Zugrundeliegende Regularien
EU-Verordnung 2017/745 (MDR)
Medizinprodukte-Durchführungsgesetz (MPDG)
ISO 14155
1. Einleitung
Die Literatursuche ist im regulatorischen Umfeld von Medizinprodukten ein elementarer Prozess, der in verschiedenen Phasen des Lebenszyklus erfolgt. Sie ist nicht nur bei der klinischen Bewertung relevant, sondern auch im Kontext
- der klinischen Strategie,
- der Entwicklungsstrategie,
- des Risikomanagements
- in Verbindung mit klinischen Prüfungen, PMCF-Studien
- bei DiGAs hinsichtlich der systematischen Datenerhebung
Dieser Beitrag beantwortet deshalb zunächst die Frage: Wann führe ich bei Medizinprodukten eine Literatursuche durch? Dabei wird auf die verschiedenen Kontextsituationen und die Gestaltung der Suche in der jeweiligen Situation eingegangen.
Darüber hinaus zeigen wir auch, wie man eine effektive Literatursuche durchführt und bieten praktische Beispiele zur Gestaltung der Suchstrategie in den verschiedenen Situationen.
2. Literatursuche und Klinische Daten
Wenn es um das Thema „Literatursuche“ geht, spielen natürlich klinische Daten eine wesentliche Rolle. Klinische Daten sind das Herzstück der medizinischen Forschung und bezeichnen die Erhebung von Informationen über das Produkt bei der Anwendung am Menschen. Sie umfassen eine breite Palette an Informationen, die aus klinischen Studien, Patientenbeobachtungen, Forschungsergebnissen und anderen medizinischen Quellen gewonnen werden. Diese Daten sind für die Bewertung der Wirksamkeit, Sicherheit und Qualität von Medizinprodukten unverzichtbar. Sie bilden die Grundlage für regulatorische Entscheidungen und tragen maßgeblich zur Entwicklung innovativer medizinischer Lösungen bei.
Klinische Daten werden in Verbindung mit Medizinprodukten in der MDR in Art. 2 folgendermaßen definiert:
„Klinische Daten“ bezeichnet Angaben zur Sicherheit oder Leistung, die im Rahmen der Anwendung eines Produkts gewonnen werden und die aus den folgenden Quellen stammen:
- klinische Prüfung(en) des betreffenden Produkts,
- klinische Prüfung(en) oder sonstige in der wissenschaftlichen Fachliteratur wiedergegebene Studien über ein Produkt, dessen Gleichartigkeit mit dem betreffenden Produkt nachgewiesen werden kann,
- in nach dem Peer-Review-Verfahren überprüfter wissenschaftlicher Fachliteratur veröffentlichte Berichte über sonstige klinische Erfahrungen entweder mit dem betreffenden Produkt oder einem Produkt, dessen Gleichartigkeit mit dem betreffenden Produkt nachgewiesen werden kann,
- klinisch relevante Angaben aus der Überwachung nach dem Inverkehrbringen, insbesondere aus der klinischen Nachbeobachtung nach dem Inverkehrbringen.“
Die Literatursuche ist demnach der Prozess, klinische Daten zu finden. Das führt uns in die Welt der medizinischen Datenbanken. Zu den wichtigsten Quellen zählen PubMed, die Cochrane Library und EMBASE. Diese Datenbanken bieten Zugriff auf eine Vielzahl von Publikationen, Fachzeitschriften, Konferenzberichten und systematischen Reviews, Meta-Analysen, Leitlinien und vieles mehr.
Der Prozess der Literatursuche erfolgt in mehreren Schritten und ist in jeder regulatorischen Situation gleich:
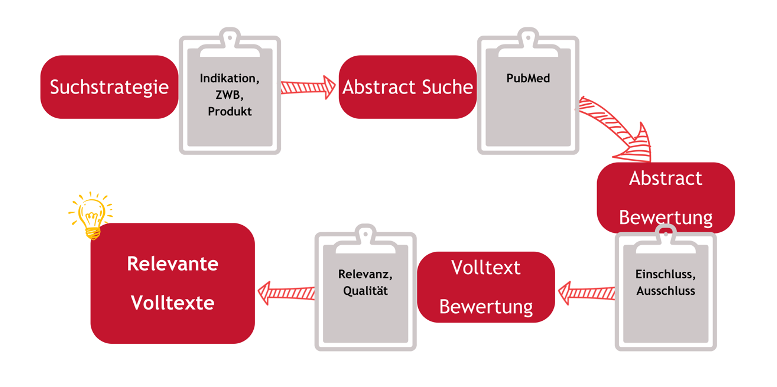
Abb. 1: Prozess der Literatursuche
Definieren der Suchstrategie: Der erste Schritt ist die sorgfältige Planung der Suchstrategie. Dabei werden relevante Schlüsselwörter und Suchbegriffe festgelegt, die den Rahmen der Recherche bilden.
Auswahl der richtigen Datenbanken: Aufgrund der Fülle an Informationen ist die Wahl der richtigen Datenbanken entscheidend. Jede Datenbank hat ihre eigenen Stärken und Spezialisierungen, die berücksichtigt werden müssen.
Durchführung der Suche: Unter Anwendung der definierten Schlüsselwörter werden die Datenbanken systematisch durchforstet. Diese Phase erfordert Geduld und Sorgfalt, um sicherzustellen, dass keine relevanten Informationen übersehen werden.
Analyse und Auswahl der Daten: Nach der Sammlung der Informationen erfolgt die kritische Bewertung der Ergebnisse. Hierbei werden die relevantesten und fundiertesten Studien und Berichte ausgewählt, die zur Beantwortung der Fragestellung beitragen.
Eine mögliche Technik, die in diesem Prozess Anwendung finden kann, ist z. B. die PICO-Technik: Sie hilft, die Suchanfragen zu präzisieren und effektiver zu gestalten. PICO steht für Population, Intervention, Comparison und Outcome. Diese Methode ermöglicht es, die Recherche auf die wichtigsten Aspekte zu fokussieren und liefert dadurch präzisere und relevantere Ergebnisse.
Diese Technik wird insbesondere im Rahmen der
- Patientenversorgung
- Behandlung
und zur Feststellung
- der Genauigkeit diagnostischer Tests
- prognostischer Faktoren
eingesetzt.
3. Literatursuche in der Praxis
Die Literatursuche ermöglicht das Treffen fundierter Entscheidungen, in diesem Rahmen spricht man auch von "evidenzbasierten" Entscheidungen Sie ist deshalb ein unverzichtbarer Teil bei der Entwicklung und Bewertung von Medizinprodukten, da sie
- eine strukturierte Basis für Entscheidungsfindungen bietet und
- die Qualität, klinische Leistung und Sicherheit von Medizinprodukten sicherstellt.
Im Produktlebenszyklus eines Medizinproduktes gibt es verschiedene Situationen, in denen eine Literatursuche notwendig wird. Jede hat spezifische Ziele und Foki haben:
- Kontext Klinische Bewertung: Plan, Bericht
- Kontext Klinische Strategie, Entwicklungsstrategie, Risikomanagement
- Kontext Klinische Prüfung, PMCF-Studie, Systematische Datenerhebung
Diese werden im Folgenden im Detail beleuchtet.
3.1 Die Literatursuche im Kontext der klinischen Bewertung
Die klinische Bewertung von Medizinprodukten (Artikel 61 der EU-Verordnung 2017/745 (MDR)) ist ein Kernelement der technischen Dokumentation und bestätigt im Rahmen der Validierung der klinischen Daten die Sicherheit des Medizinprodukts , seine klinische Leistung sowie sein Nutzen-Risiko-Verhältnis. Die Literatursuche ist ein integraler Bestandteil, um diese Informationen zu liefern. Der Prozess der "Bewertung" der klinischen Daten ist eine festgelegte Abfolge von Handlungen um die diversen Quellen, einschließlich klinischer Prüfungen zu analysieren, nicht nur inhaltlich sondern auch methodisch. Bewertungskriterien umfassen die Relevanz der Publikation, die Qualität und wissenschaftliche Gültigkeit sowie die Gewichtung der Daten im Hinblick auf die klinische Bewertung.
Die Analyse von "State of the Art" Daten erfasst den aktuellen Stand der Technik. Demgegenüber werden die Daten des zu evaluierenden Produktes gestellt um die behauptete klinische Leistung und Sicherheit des Produkts zu belegen.
Die Literaturrecherche umfasst vier Schritte:
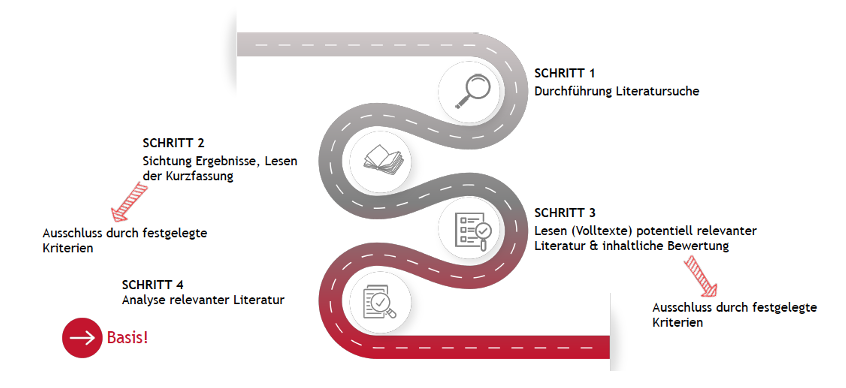
Abb. 2: Literatursuche Schritt für Schritt
Ziel der klinischen Bewertung ist es, eine fundierte Grundlage für die Marktzulassung zu schaffen und die Qualität, Sicherheit und Wirksamkeit des Medizinprodukts zu gewährleisten. Dies erfordert eine sorgfältige Dokumentation des gesamten Prozesses, einschließlich Literatursuchplan, -protokoll und -bericht, um Transparenz und Nachvollziehbarkeit für Audits und regulatorische Überprüfungen zu sichern.
3.2 Kontext klinische Strategie, Entwicklungsstrategie, Risikomanagement
Klinische Strategie:
In diesen Bereichen erleichtert die Literatursuche das Identifizieren von potenziellen Risiken und die Entwicklung von Strategien zur Risikominderung. Sie unterstützt auch die Formulierung einer langfristigen klinischen Strategie und Entwicklungsstrategie, die auf aktueller Forschung und bestehenden Daten basiert. Sie legt somit das Fundament für die Route der klinischen Bewertung und stellt die Weichen für die gesamte Planung des Entwicklungsprozesses im Hinblick auf Kosten und Zeit.
Risikomanagement:
Das Risikomanagement ist die systematische Anwendung von Managementstrategien zur Identifikation und Kontrolle von Produktrisiken. Es besteht eine enge Schnittstelle zwischen Risikomanagement und klinischer Bewertung, besonders beim Einbezug des aktuellen medizinischen und technologischen State of the Art.
Literatursuche im Kontext der Klinischen Strategie erfolgterfolgt hier ebenfalls in vier Schritten (s. Abbildung 2).
Ein Fokus liegt auf der Suche nach ähnlichen Produkten, um Äquivalenzen zu bewerten, Nebenwirkungen zu identifizieren und Marktdaten einzubeziehen. Auch das Anwendungsgebiet des Produkts wird untersucht, einschließlich Prävalenz und Inzidenz relevanter Zustände oder Krankheiten, alternativer Anwendungsformen und aktueller medizinischer Leitlinien.
3.3 Kontext klinische Prüfung, PMCF-Studie, systematische Datenerhebung
Klinische Prüfung:
Die klinische Prüfung wird in der Projektplanungsphase konzipiert und mit dem finalen Produkt im Rahmen der Produktvalidierung durchgeführt. Die gesammelten Daten fließen in den Clinical Evaluation Report (CER) ein und sind entscheidend für den Markteintritt des Produkts. Sie erfolgt gemäß den gesetzlichen Anforderungen wie MDR und ISO 14155.
Die Literatursuche im Kontext Klinischer Prüfung erfolgt wieder in vier Schritten (s. Abbildung 2). Der Fokus liegt hier auf der Identifikation relevanter Endpunkte, auf Basis derer die Forschungsfrage beantwortet werden soll. Des weiteren sollen Ideen für ein potentielles Studiendesign gesammelt werden.
DiGA:
Für digitale Gesundheitsanwendungen (DiGAs) ist eine Literatursuche nach dem "minimally important difference/change" (MCID) für die systematische Datenerhebung und Auswertung der zum Produkt erhobenen Daten entscheidend, um die klinische Bedeutung der Daten zu bewerten und entsprechend einordnen zu können. Aber insbesondere für das Evaluationskonzept wird im DiGA-Leitfaden eine systematische Literaturrecherche gefordert: Sie soll Indizien für den positiven Versorgungseffekt liefern.
4. Digitale Literatursuche
Wie wichtig und zentral die Literatursuche in Zusammenhang mit Medizinprodukten und zwar über den gesamten Produktlebenszyklus ist, haben wir gesehen.
medXteam hat sich spezialisiert auf die Erhebung und Auswertung klinischer Daten: So steht die Literatursuche bei uns im Mittelpunkt. Die Durchführung von objektiven Recherchen in Pubmed und Pubmed Central kann mit digitalen Softwarelösungen teilautomatisiert werden, um eine nachvollziehbare und reproduzierbare Recherchedokumentation zu gewährleisten sowie den Aufwand für die Dokumentation der Rechercheergebnisse zu reduzieren. Die eingesetzte Lösung (Polarion mit avaPubmed-Erweiterung) bietet eine direkte, validierte Schnittstelle zu Pubmed und Pubmed Central.
4.1 Digitalisierte Literatursuche über Polarion
Die Literatursuche ist der Kernprozess der klinischen Bewertung.
Bei der Literatursuche über Polarion wird eine direkte Verbindung zu den Datenbankquellen (z. B. direkt zu PubMed) hergestellt.
Die Literaturrecherche wird in Form der folgenden Dokumente durchgeführt und dokumentiert:
- Literatursuch- und Reviewplan (engl. Literature Search and Review Plan)
Der Literatursuch – und Review-Plan beschreibt die objektive Suche und beschreibt die Identifizierung von Publikationen. Er umfasst:
- Quellen der Publikationen
- Suchbegriffe
- definierte Filter
- Beurteilungskriterien und Prozess für identifizierte Publikationen
- Prozess zur Analyse der relevanten Publikationen
- Durchführungsprotokoll der Literaturrecherche (engl. Literature Search Execution Protocol)
Das Durchführungsprotokoll liefert Details zu den durchgeführten Recherchen und einen Überblick über die Historie der Recherchen. Es umfasst:
- verwendete Suchanfragen und Ergebnisse
- Abweichungen vom Literatursuch- und Reviewplan
- Übersicht über durchgeführte Recherchen und Suchergebnisse
- Bericht zur Literaturrecherche (engl. Literature Review Report)
Der Bericht enthält eine Zusammenfassung der durchgeführten Suche, sowie die Auswertung und Analyse. Er umfasst:
- Zusammenfassung der objektiven Suchdurchführung und -ergebnisse
- durchgeführte Suche und Auswahlverfahren zur Identifizierung mit anderen Mitteln
- Bewertung der identifizierten Publikationen
- Analyse der relevanten Publikationen (siehe nachfolgender Abschnitt)
4.2 Dokumentation der Analyse
Der Volltext jeder potenziell relevanten Publikation wird gelesen und im Hinblick auf das Ziel (Scope) der Literaturrecherche und die relevanten klinischen Bewertungsthemen im jeweiligen klinischen Bewertungsplan analysiert. Die extrahierten Aussagen zu Sicherheit, Leistung, Nutzen, Anspruch oder Stand der Technik werden dokumentiert.
Die Analyse einer einzelnen "Publikation" wird in Form einer einzelnen "Publikationsbewertung" (engl. „Publication Evaluation“ siehe Schaubild unten) dokumentiert: Die "Publikation" ist mit der "Publikationsbewertung" verknüpft und die Bewertung ist mit dem jeweiligen "Klinischen Bewertungsgegenstand" im Klinischen Bewertungsplan verknüpft. Die folgende Grafik erläutert den Zusammenhang zwischen den einzelnen Workitem-Typen:
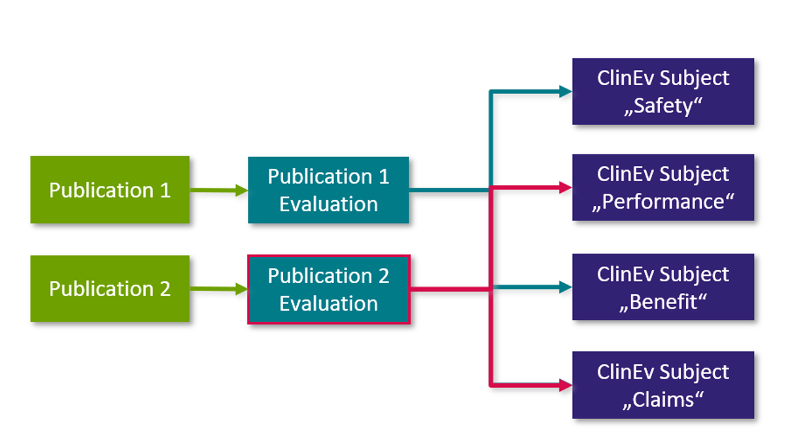
Abb. 3: Analyse
4.3 Bericht zur Literaturrecherche
Im Bericht zur Literaturrecherche wird eine Übersicht und Zusammenfassung der Analyse gegeben:
Es wird für jedes Klinische Bewertungsthema aufgeführt, welche Publikation mit Relevanz für dieses Thema identifiziert wurde und welche spezifischen Aussagen in der Publikationsbewertung extrahiert wurden.
Basierend auf diesen Ergebnissen wird analysiert, ob die relevanten Datensätze in ihrer Gesamtheit Evidenz für das jeweilige Clinical Evaluation Subject (den jeweiligen Claim, siehe Abbildung oben) zeigen. Das Ziel ist es, nach Konsistenz der Ergebnisse über bestimmte Klinische Bewertungsthemen hinweg zu suchen. Wenn unterschiedliche Ergebnisse über die Datensätze hinweg beobachtet werden, ist es hilfreich, den Grund für diese Unterschiede zu ermitteln.
Die folgende Grafik visualisiert den Zusammenhang der Dokumente und der enthaltenen digitalen Inhalte in Form von Workitems:
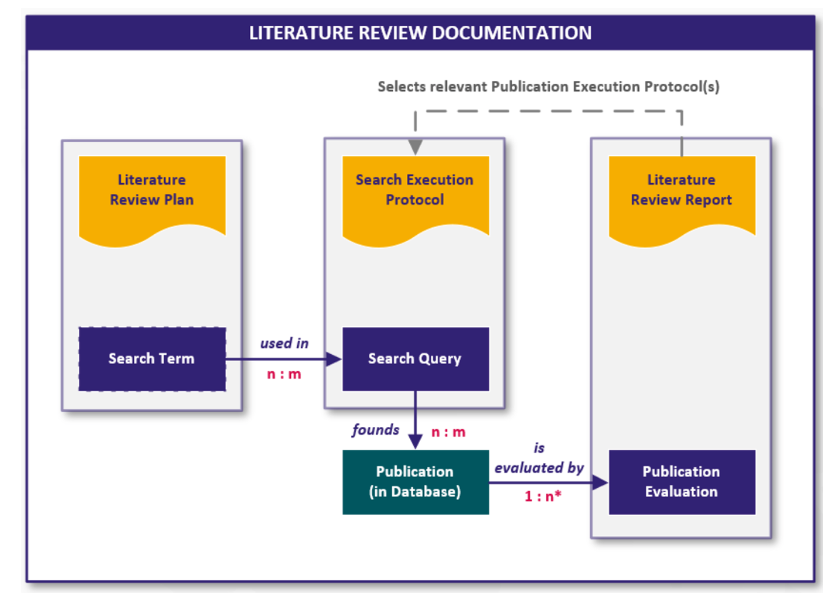
Abb. 4 Schnittstellen und Work Items
4.4 Digitalisierte klinische Bewertung
Die Digitalisierung greift natürlich insbesondere hier:
Kern der klinischen Bewertung ist die Literatursuche, die digitalisiert durchgeführt werden kann (s. o.). Eingebettet in Polarion als Subsystem kann auch sie selbst digitalisiert werden. Die folgende Abbildung gibt einen Überblick über den Inhalt der Dokumente zur klinischen Bewertung
- CEP,
- CER,
- Dokumente zur Literatursuche – Plan, Protokoll, Bericht
eingebettet als Subsystem in das Gesamtsystem Technische Dokumentation:
4.5 Vorteile der Digitalisierung
Die Digitalisierung der Technischen Dokumentation für Medizinprodukte und damit der klinischen Bewertung und der Literatursuche ist die Zukunft!
Die Vorteile der Digitalisierung liegen auf der Hand:
- effizienteres Arbeiten
- zielorientiertes Einsetzen der Kapazitäten
- Beseitigung von Ineffizienzen bei Erstellung, Pflege und Änderung von Inhalten der Technischen Dokumentation, klinischen Bewertung und Literatursuchen
- langfristige Verringerung des Pflegeaufwands
Über Polarion lassen sich Schnittstellen wie Zweckbestimmung, Risikomanagement, Gebrauchstauglichkeit, klinische Bewertung, klinische Prüfung Projekten zuordnen und bei Bedarf wiederverwenden. Die Erstellung und Pflege von Dokumenten wird somit deutlich vereinfacht und beschleunigt. Daneben werden Redundanzen und Inkonsistenzen vermieden.
5. Schlussfolgerung
Gemäß MDR Art. 2 umfassen klinische Daten Informationen über Sicherheit und Leistung, die aus klinischen Prüfungen, Fachliteratur, Berichten über klinische Erfahrungen und der Überwachung nach dem Inverkehrbringen stammen. Diese Datenquellen sind entscheidend für eine effektive Literatursuche. Die Suche in der Fachliteratur, wo wir klinische Daten finden, und die Bedeutung dieser Daten für verschiedene Aspekte der Medizinproduktentwicklung, illustrieren, wie grundlegend die Literatursuche für den gesamten Entwicklungsprozess ist.
Die Literatursuche bei Medizinprodukten ist mehr als nur ein Schritt im Entwicklungsprozess; sie ist ein kontinuierlicher Prozess, der die Qualität und Sicherheit von Medizinprodukten entscheidend beeinflusst. Sie ermöglicht es Herstellern, Forschern und klinischen Experten, fundierte Entscheidungen zu treffen, die auf den neuesten wissenschaftlichen Erkenntnissen basieren. In einer Branche, die sich ständig weiterentwickelt, bleibt die Literatursuche ein wesentlicher Bestandteil, um innovative und sichere Medizinprodukte zu gewährleisten.
Eine Literatursuche ist für alle Medizinprodukte über den gesamten Produktlebenszyklus essentiell, nämlich: Um klinische Daten zu gewinnen!
6. Wie wir Ihnen helfen können
Aufgrund der hohen Nachfrage haben wir eine spezielle Online-Schulung produziert:
Diese Schulung ist darauf ausgelegt, Fachkräften im Bereich der Medizinprodukte eine umfassende Anleitung zur effektiven Literatursuche in verschiedenen Konstellationen mit dem Schwerpunkt auf der klinischen Bewertung zu bieten. Die Schulung ist in vier Lektionen gegliedert, die sowohl theoretische Grundlagen als auch praktische Anwendungsbeispiele umfassen.
Lektion 1: Literatursuche und klinische Daten
Lektion 2: Literatursuche in der Praxis
Lektion 3: Einstieg in die Praxis: Erstes Praxisbeispiel
Lektion 4: Weitere Praxisbeispiele
Klinische Prüfungen:
Ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss, klären wir bei medXteam im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Wenn eine klinische Prüfung durchgeführt werden soll, müssen zuvor grundlegende Sicherheits- und Leistungsanforderungen erfüllt sein. Die Daten aus der klinischen Prüfung münden dann in die klinische Bewertung, die wiederum die Basis für Post-Market-Clinical-Follow-up (PMCF)-Aktivitäten (einschließlich einer PMCF-Studie) darstellt.
Außerdem benötigen alle Hersteller von Medizinprodukten ein Qualitätsmanagement system (QMS), auch bei der Entwicklung von Produkten der Klasse I.
Wir unterstützen Sie während Ihres kompletten Vorhabens mit Ihrem Medizinprodukt, beginnend bei einer kostenlosen Erstberatung, Hilfe bei der Einführung eines QM Systems, Studienplanung und Durchführung bis hin zur Technischen Dokumentation - immer mit primärem Bezug auf die klinischen Daten zum Produkt: von Anfang an bis zum Ende.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung
