Warum ist die klinische Strategie bei der Medizinprodukteentwicklung so wichtig?
Bei medXteam stehen klinische Daten im Mittelpunkt. In diesem Kontext führen wir als CRO nicht nur klinische Prüfungen mit Medizinprodukten gemäß MDR und ISO 14155 durch, sondern bieten auch sämtliche weiteren Möglichkeiten und Formen der Datenerhebung und Produktzulassung sowie Marktüberwachung an. Schon ganz am Anfang einer Produktidee, aber auch in Bezug auf den MDR-Transfer von Bestandsprodukten, spielt die klinische Strategie eine wesentliche Rolle. Sie ebnet nicht nur den Weg für die Erhebung und Bewertung der erforderlichen klinischen Daten, sondern ist auch die Basis für Zeit- und Kostenplanungen. Auf genau diese elementare Rolle geht nun dieser Blogbeitrag ein: Was ist die klinische Strategie und warum ist sie so entscheidend?
Abkürzungen
MDR Medical Device Regulation; EU-Verordnung 2017/745
PMCF Post-Market Clinical Follow-up, klinische Nachbeobachtung
CEP Clinical Evaluation Plan
CDP Clinical Development Plan
Zugrundeliegende Regularien
EU-Verordnung 2017/745 (MDR)
1. Einleitung
Die Entwicklung eines neuen Produkts oder der MDR-Transfer eines Bestandsprodukts stellt Hersteller von Medizinprodukten vor umfangreiche Herausforderungen. Eine davon ist die frühzeitige Entwicklung einer klinischen Strategie. Die MDR verlangt in Anhang XIV explizit die Erstellung eines klinischen Entwicklungsplans. Dieser Plan soll alle Phasen von der Idee bis zur Markteinführung und darüber hinaus abdecken, einschließlich explorativer Studien, Durchführbarkeitsstudien, Pilotstudien, Bestätigungsstudien wie pivotaler klinischer Prüfungen und der klinischen Überwachung nach dem Inverkehrbringen. Die Definition von Etappenzielen und die Beschreibung möglicher Akzeptanzkriterien sind dabei wesentliche Bestandteile.
Die Bedeutung einer solchen klinischen Strategie lässt sich auf mehrere Schlüsselfaktoren zurückführen. Einerseits ermöglicht sie eine klare Strukturierung und Planung des Entwicklungsprozesses. Durch die frühzeitige Festlegung von Zielen und Kriterien können Entwicklungszeit und -kosten effizient gesteuert und potenzielle Risiken minimiert werden. Andererseits dient die klinische Strategie nicht nur der Erfüllung regulatorischer Anforderungen, sondern auch der Sicherstellung, dass das Produkt später den Patienten den größtmöglichen Nutzen bringen wird. Sie unterstützt Hersteller dabei, frühzeitig evidenzbasierte Entscheidungen zu treffen und das Produkt im Hinblick auf seine klinische Leistung, Sicherheit und seinen Nutzen einordnen zu können.
Zusätzlich liefert die klinische Strategie wertvollen Input für das Risikomanagement. Ein wesentlicher Teil der Strategie umfasst die Durchführung einer umfassenden Literaturrecherche, um bestehendes Wissen über ähnliche Produkte oder Technologien zu integrieren und frühzeitig potenzielle Risiken zu identifizieren. Diese Informationen sind entscheidend, um Risiken zu bewerten, zu steuern und letztendlich zu minimieren.
Wie das funktioniert und was dabei zu beachten ist, wird nun im Folgenden beschrieben.
2. Produktidee, Entwicklungsbeginn oder Neuanfang mit der MDR
Egal, ob es sich um ein neues Produkt handelt, eine Idee zu einem neuen Produkt geboren wurde oder das Bestandsprodukt an die MDR-Anforderungen angepasst werden muss, es ist immer zu prüfen, welche Daten und klinischen Daten für die Erstellung der initialen klinischen Bewertung benötigt werden. Wurde diese erstellt, so ist sie dann regelmäßig zu aktualisieren, im Bereich der klinischen Nachbeobachtung (Post-Market Clinical Follow-up, PMCF) sind klinische Daten zu erheben. Darüber hinaus ist im Plan zur klinischen Bewertung (Clinical Evaluation Plan, CEP) ein sogenannter klinischer Entwicklungsplan (Clinical Development Plan, CDP) zu erstellen, der im Grunde eben genau das, nämlich welche Daten benötigt werden und erhoben werden müssen, enthält. Um das nun festlegen zu können, wird eine klinische Strategie benötigt.
2.1 Was ist die klinische Strategie?
Die klinische Strategie ist ein umfassender, systematischer Ansatz, der die Identifikation, Sammlung, Analyse und Aktualisierung von klinischen Daten über den gesamten Lebenszyklus eines Medizinprodukts hinweg steuert. Sie dient dazu, die Sicherheit, Wirksamkeit und Leistung des Produkts zu bewerten und zu dokumentieren, sowohl bei der initialen Entwicklung als auch bei der Anpassung an regulatorische Anforderungen wie die der Medizinprodukteverordnung (MDR). Kernstück der klinischen Strategie ist die Erstellung und regelmäßige Aktualisierung einer initialen klinischen Bewertung. Diese Bewertung erfordert eine sorgfältige Prüfung, welche spezifischen Daten und klinischen Beweise benötigt werden, um den Nutzen und die Risiken des Produkts zu belegen.
Die klinische Strategie bildet die Basis für den Clinical Evaluation Plan (CEP), der einen Clinical Development Plan (CDP) beinhaltet. Diser CDP definiert detailliert, welche Daten und klinischen Nachweise für die Erstellung der klinischen Bewertung erforderlich sind und wie diese erhoben werden sollen. Dies umfasst sowohl die Planung und Durchführung von Studien vor der Markteinführung (wie First-in-man-Studien, Durchführbarkeitsstudien, Pilotstudien und pivotale klinische Prüfungen) als auch die fortlaufende Sammlung von Daten nach der Markteinführung durch Post-Market Clinical Follow-up (PMCF) Maßnahmen.
Die klinische Strategie ist somit die Grundlage für die kontinuierliche Erhebung von (klinischen) Daten über den gesamten Produktlebenszyklus hinweg. Durch die frühzeitige und systematische Planung klinischer Daten und Bewertungen hilft die klinische Strategie, Risiken zu minimieren, Entwicklungseffizienz zu steigern, bestehende Lücken (Gaps) aufzuzeigen und letztendlich die Markteinführung oder den MDR-Transfer von Medizinprodukten zu beschleunigen.
2.2 Aufbau einer klinischen Strategie
Die Entwicklung einer klinischen Strategie stellt einen vielschichtigen und unverzichtbaren Vorgang dar, der weitreichende Bereiche umfasst und tiefgehend in die Planung sowie Umsetzung der Entwicklung und Beurteilung von Medizinprodukten eingebettet ist. Nachfolgend werden die methodische Strukturierung und die Inhalte einer solchen Strategie ausführlich erörtert. Die klinische Strategie ist ein umfassendes Konzept, das diverse Aspekte abdeckt, um letztlich fundierte Schlussfolgerungen bezüglich des Produkts zu ermöglichen.
2.2.1 Produktbeschreibung mit Zweckbestimmung
Zu Beginn der klinischen Strategie steht die detaillierte Produktbeschreibung. Diese umfasst die Zweckbestimmung des Produkts, einschließlich der technischen Merkmale sowie der vorgesehenen Indikationen und Kontraindikationen. Darüber hinaus werden die Zielgruppen, also Patienten und Anwender, definiert. Diese erste Einordnung ist grundlegend, um das Produkt im medizinischen Kontext richtig zu positionieren und bildet die Basis für alle weiteren Schritte.
2.2.2 Spezifischer Entwicklungsprozess
Anschließend wird der spezifische Entwicklungsprozess für das Produkt aufgezeigt. Hierbei werden die relevanten Leistungs- und Sicherheitsbestimmungen gemäß Anhang I der MDR berücksichtigt. Somit findet eine weitere Einordnung des Produktes statt, um dann die richtigen Schlüsse für das weitere Vorgehen daraus fundiert ziehen zu können.
2.2.3 Dokumente und Nachweise
Ein weiterer wesentlicher Bestandteil der klinischen Strategie ist die Definition der zu erstellenden Dokumente und der benötigten Nachweise gemäß Anhang II und III der MDR für die technische Dokumentation des Produktes. Diese Dokumente umfassen insbesondere die notwendigen Dokumente und Testverfahren zur Verifizierung und Validierung des Produktes, da dies ggf. für die Entscheidung für die richtige Route der klinischen Bewertung von Bedeutung ist.
2.2.4 Bestimmung ähnlicher Produkte
Ein wichtiger Schritt innerhalb der klinischen Strategie ist die Bestimmung ähnlicher oder gegebenenfalls sogar äquivalenter Produkte. Diese Analyse ermöglicht es, bereits vorhandenes Wissen und Daten zu nutzen, um die Entwicklung und Bewertung des eigenen Produkts zu unterstützen. Durch den Vergleich mit ähnlichen Produkten oder Anwendungen im selben Anwendungsgebiet lässt sich besser abschätzen, welche klinischen Daten bereits vorhanden oder erforderlich sind und wie diese am besten erhoben werden können.
2.2.5 Literatur- und Sicherheitsdatenbankensuche
Die klinische Strategie umfasst dann natürlich eine Literatursuche sowie die Suche in Sicherheitsdatenbanken nach ähnlichen oder äquivalenten Produkten. Diese Recherche dient dazu, den aktuellen Stand der Technik (State of the Art) zu erfassen und sicherzustellen, dass alle relevanten klinischen Daten und Informationen über Sicherheitsaspekte und über ähnliche Anwendungen, das Anwendungsgebiet des Medizinprodukts etc. berücksichtigt werden.
2.2.6 Einordnung des Produktes in den Anwendungskontext
Die gezielte Einordnung des Produkts in seinen Anwendungskontext baut auf den Erkenntnissen auf, die aus den vorangegangenen Schritten gewonnen wurden. Insbesondere die umfassende Literatursuche leistet hierzu einen wesentlichen Beitrag. Durch die Analyse vorhandener Daten zu ähnlichen oder äquivalenten Produkten und die Bewertung des aktuellen Stands der Technik können wichtige Einblicke in die praktischen Anwendungsbedingungen und die Bedürfnisse der Zielgruppe gewonnen werden.
Durch die Integration dieser vielfältigen Informationen wird die Einordnung des Produktes in den Anwendungskontext möglich. Diese berücksichtigt nicht nur die theoretische Zweckbestimmung des Produkts, sondern reflektiert auch dessen Einsatz in realen klinischen oder häuslichen Umgebungen. So kann eine realitätsnahe Einschätzung der Produktleistung unter typischen Anwendungsbedingungen erfolgen, was wiederum die Produktentwicklung und -bewertung optimiert.
2.3 Schlussfolgerungen aus der klinischen Strategie
Die sorgfältige Entwicklung einer klinischen Strategie für Medizinprodukte bringt weitreichende Schlussfolgerungen mit sich, die für die Ausrichtung des Produkts und dessen explizite Strategie entscheidend sind. Diese Schlussfolgerungen bieten nicht nur einen Leitfaden für die klinische Bewertung und den Entwicklungsprozess, sondern tragen auch dazu bei, das Produkt optimal auf den Markt und die Anwendung oder auf den MDR-Transfer vorzubereiten.
2.3.1 Fundament für die Route der klinischen Bewertung
Die klinische Strategie legt das Fundament für die Route der klinischen Bewertung und richtet die Planung des Entwicklungsprozesses strategisch aus. Hierbei sind drei Wege möglich:
1. Klinische Bewertung über eigene klinische Daten
Die Entscheidung für die Durchführung eigener klinischer Prüfungen ist dann notwendig, wenn keine alternativen Wege über Leistungsdaten oder Daten zu Äquivalenzprodukten gangbar sind, oder wenn das Produkt innovative klinische Claims aufweist, die eindeutig mit klinischen Daten untermauert werden müssen. Dieser Ansatz ist oft mit höheren Kosten und einem längeren Zeitrahmen verbunden.
2. Leistungs-/Verifizierungsdaten (MDR Art. 61(10))
Das Heranziehen von Verifizierungs- und Leistungsdaten sowie zusätzlicher Literatur zu ähnlichen Produkten ist eine weitere mögliche Route immer dann, wenn der direkte Nachweis der Übereinstimmung mit den grundlegenden Sicherheits- und Leistungsanforderungen auf Basis klinischer Daten für ungeeignet erachtet wird. Dieser Ansatz ist in der Regel zeit- und kosteneffizient, erfordert jedoch eine fundierte Begründung, warum er als angemessen betrachtet wird.
3. Daten zu Äquivalenzprodukten
Die Nutzung von Daten zu Äquivalenzprodukten ist eine weitere Möglichkeit, vorausgesetzt, es existieren solche Produkte und es liegen klinische Daten zu diesen vor. Diese Route war lange der Goldstandard der klinischen Bewertung. Durch die gestiegenen MDR-Anforderungen insbesondere an
- implantierbare Klasse IIb und
- alle Klasse III Produkte
sowie gestiegenen Anforderungen an den Äquivalenznachweis z. B. für Software findet diese kaum noch statt. Sollte dieser Weg dennoch möglich sein, kann damit natürlich die Notwendigkeit eigener klinischer Daten umgangen werden, was potenziell den Entwicklungsprozess natürlich beschleunigt.
2.3.2 Aufdeckung weiterer Risiken und Nebenwirkungen
Die umfassende Sammlung und Analyse von Daten im Rahmen der klinischen Strategie hilft, weitere, bislang unbekannte Risiken und Nebenwirkungen, zu identifizieren. Diese Erkenntnisse sind auch von großem Wert für das Risikomanagement und ermöglichen eine präzisere Bewertung alternativer Anwendungen des Produkts. Durch das frühzeitige Erkennen von potenziellen Risiken können Maßnahmen zur Risikominimierung implementiert und die Sicherheit des Produkts für die Anwender und Patienten maximiert werden.
2.3.3 Identifikation und Schließung von Lücken in klinischen Daten
Ein weiterer kritischer Aspekt der klinischen Strategie ist die Identifikation möglicher Lücken in Bezug auf die erforderlichen klinischen Daten. Die frühzeitige Erkennung solcher Defizite ermöglicht es, gezielte Maßnahmen zu ergreifen, um diese Lücken adäquat zu schließen. Dies kann durch zusätzliche eigene Datenerhebungen (z. B. Planung einer klinischen Prüfung, da ein klinischer Claim sich bisher nicht über klinische Daten belegen lässt), die Sammlung von Post-Market- oder PMCF-Daten oder die erneute Analyse bestehender Daten erfolgen.
3. Literatursuche für die klinische Strategie
Die Literatursuche als Kernpunkt der klinischen Strategie erleichtert auf der einen Seite die Einordnung des Produktes in sein Anwendungsgebiet. Sie führt außerdem zur Identifizierung von potenziellen Risiken und hilft bei der Entwicklung von Strategien zur Risikominderung. Sie unterstützt letztendlich die Formulierung einer langfristigen klinischen Strategie und Entwicklungsstrategie, die auf genau den damit erhobenen Daten basiert.
Der Prozess der Literatursuche erfolgt in mehreren Schritten:
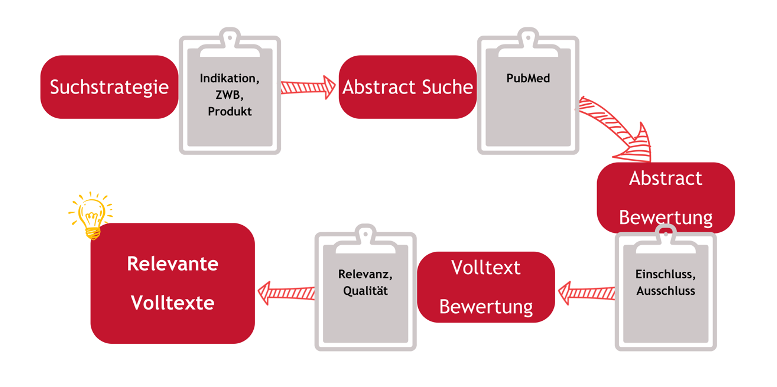
Abb. 1: Prozess der Literatursuche
Definieren der Suchstrategie: Der erste Schritt ist die sorgfältige Planung der Suchstrategie. Dabei werden relevante Schlüsselwörter und Suchbegriffe festgelegt, die den Rahmen der Recherche bilden.
Auswahl der richtigen Datenbanken: Aufgrund der Fülle an Informationen ist die Wahl der richtigen Datenbanken entscheidend. Jede Datenbank hat ihre eigenen Stärken und Spezialisierungen, die berücksichtigt werden müssen.
Durchführung der Suche: Unter Anwendung der definierten Schlüsselwörter werden die Datenbanken systematisch durchforstet. Diese Phase erfordert Geduld und Sorgfalt, um sicherzustellen, dass keine relevanten Informationen übersehen werden.
Analyse und Auswahl der Daten: Nach der Sammlung der Informationen erfolgt die kritische Bewertung der Ergebnisse. Hierbei werden die relevantesten und fundiertesten Studien und Berichte ausgewählt, die zur Beantwortung der Fragestellung beitragen.
Die Analyse von "State of the Art" Daten, welche für die klinische Strategie benötigt werden, erfasst den aktuellen Stand der Technik.
Die Literaturrecherche umfasst vier Schritte:
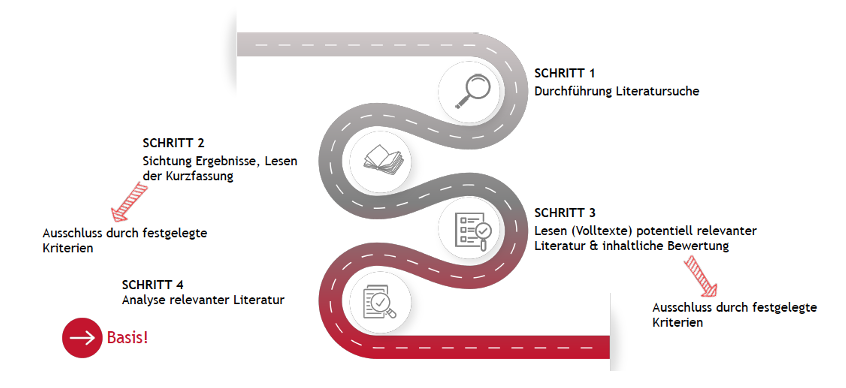
Abb. 2: Literatursuche Schritt für Schritt
4. Schlussfolgerung
Die Entwicklung und Umsetzung einer klinischen Strategie für Medizinprodukte ist ein entscheidender Schritt, der weit über die bloße Erfüllung regulatorischer Anforderungen hinausgeht. Sie bietet ein strukturiertes Vorgehen, um die Sicherheit, Wirksamkeit und Leistung eines Produkts systematisch zu bewerten und zu dokumentieren. Dieser Prozess trägt maßgeblich dazu bei, das Produkt optimal auf die Bedürfnisse der Anwender und Patienten abzustimmen und gleichzeitig den regulatorischen Rahmenbedingungen gerecht zu werden.
Durch die detaillierte Planung und Analyse, die eine klinische Strategie erfordert, können Entwickler und Hersteller von Medizinprodukten fundierte Entscheidungen treffen, die den gesamten Lebenszyklus des Produkts beeinflussen. Von der initialen Produktkonzeption über die Markteinführung bis hin zur Nachmarktbeobachtung ermöglicht die Strategie eine fortlaufende Bewertung und Anpassung des Produkts an sich ändernde klinische und regulatorische Anforderungen. Und das sowohl für neue Entwicklungen und Produktideen als auch für den MDR-Transfer eines Bestandsprodukts.
Die Wahl der Route für die klinische Bewertung, sei es durch eigene klinische Daten, Leistungsdaten oder Daten zu Äquivalenzprodukten, legt das Fundament für den Entwicklungsprozess und bestimmt maßgeblich den Zeit- und Kostenaufwand. Darüber hinaus ermöglichen die systematische Aufdeckung und Bewertung von Risiken und Nebenwirkungen sowie die Identifikation und Schließung von Lücken in den klinischen Daten eine kontinuierliche Verbesserung des Produkts und seiner (geplanten) Anwendung.
Zusammenfassend lässt sich sagen, dass die Erstellung und Umsetzung einer klinischen Strategie nicht nur eine regulatorische Notwendigkeit ist, sondern auch eine Chance darstellt, Medizinprodukte zu optimieren und deren Erfolg im Markt zu sichern. Sie fördert eine tiefgreifende Auseinandersetzung mit dem Produkt und dessen Anwendungskontext, verbessert die Qualität und Sicherheit für die Endnutzer und Patienten und unterstützt eine effiziente Produktentwicklung. In einer Branche, die von Innovationen und stetigem Wandel geprägt ist, bildet die klinische Strategie somit einen zentralen Pfeiler für den langfristigen Erfolg von Medizinprodukten.
5. Wie wir Ihnen helfen können
Als CRO unterstützen wir Sie über den gesamten Prozess der Generierung und Bewertung klinischer Daten und bei der Zulassung und Marktüberwachung Ihres Produkts. Und dabei beginnen wir mit der klinischen Strategie!
Im Falle von klinischen Prüfungen überlegen wir gemeinsam mit Ihnen, ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss. Das klären wir im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Wenn eine klinische Prüfung durchgeführt werden soll, müssen zuvor grundlegende Sicherheits- und Leistungsanforderungen erfüllt sein. Die Daten aus der klinischen Prüfung münden dann in die klinische Bewertung, die wiederum die Basis für Post-Market-Clinical-Follow-up (PMCF)-Aktivitäten (ggf. einschließlich einer PMCF-Studie) darstellt.
Außerdem benötigen alle Hersteller von Medizinprodukten ein Qualitätsmanagement system (QMS), auch bei der Entwicklung von Produkten der Klasse I.
Wir unterstützen Sie während Ihres kompletten Vorhabens mit Ihrem Medizinprodukt, beginnend bei einer kostenlosen Erstberatung, Hilfe bei der Einführung eines QM Systems, Studienplanung und Durchführung bis hin zur Technischen Dokumentation - immer mit primärem Bezug auf die klinischen Daten zum Produkt: von Anfang an bis zum Ende.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung
