Bei medXteam stehen klinische Daten im Mittelpunkt. In diesem Kontext führen wir als CRO nicht nur klinische Prüfungen mit Medizinprodukten gemäß MDR und ISO 14155 durch, sondern bieten auch sämtliche weiteren Möglichkeiten und Formen der Datenerhebung an. Egal, für welche Form der Datenerhebung man sich entscheidet: Wichtig ist eine solide Planung aber auch das Auseinandersetzen mit den verschiedenen Optionen und den jeweiligen Anforderungen daran. Bei klinischen Prüfungen mit Medizinprodukten spielt insbesondere der Sponsor eine tragende Rolle: Er ist nämlich für die ordnungsgemäße Planung und Durchführung der klinischen Prüfung verantwortlich.
Abkürzungen
MDR Medical Device Regulation; EU-Verordnung 2017/745
MPDG Medizinproduktedurchführungsgesetz
MPAnpG Medizinprodukteanpassungsgesetz
Zugrundeliegende Regularien
EU-Verordnung 2017/745 (MDR)
Medizinprodukte-Durchführungsgesetz (MPDG)
ISO 14155
1. Einleitung
Klinische Prüfungen sind ein wesentlicher Bestandteil des Medizinprodukterechts, um die Sicherheit und Leistungsfähigkeit von Medizinprodukten zu gewährleisten. Die ISO 14155 legt die Anforderungen an die Durchführung dieser klinischen Prüfungen fest. In diesem Beitrag wollen wir uns zunächst die Rolle des Prüfers und dann intensiv die wichtige Rolle des Sponsors genauer anschauen und ihre jeweiligen Aufgaben und Verantwortlichkeiten herausarbeiten.
Welche Auswirkungen die verantwortungsvolle Rolle des Sponsors hat und was hier zu beachten ist – am besten schon, bevor es am Prüfzentrum losgeht – das wird dieser Beitrag ans Licht bringen.
2. Rolle des Prüfers
2.1 Definition und Ernennung
Ein Prüfer ist in einer Prüfstelle im Rahmen der klinischen Prüfung tätig. Der Hauptprüfer ernennt diesen, wobei die Benennung in Abstimmung mit dem Sponsor erfolgen sollte. Dies ist entscheidend, da der Sponsor der Ethik-Kommission bei Antrag auf die ethische Prüfung die Prüfer und deren Qualifikation mitteilen muss.
2.2 Aufgaben des Prüfers
Die Rolle des Prüfers in klinischen Prüfungen gemäß ISO 14155 ist von zentraler Bedeutung und wird durch die Norm sowie das Medizinprodukterecht (MPDG) klar definiert. Es werden sowohl direkte als auch indirekte Anforderungen an den Prüfer gestellt, um die Qualität, Integrität und Sicherheit der klinischen Prüfungen zu gewährleisten. Einige der spezifischen Aufgaben und Verantwortlichkeiten des Prüfers sind:
- Durchführung prüfungsbezogener klinischer Verfahren und Treffen wichtiger prüfungsrelevanter klinischer und medizinischer Behandlungsentscheidungen.
- Sicherstellung, dass die klinische Prüfung in Übereinstimmung mit dem Prüfplan ausgeführt wird (gemäß § 62 Abs. 1 Nr. 1 MPDG).
- Sofern der Prüfer ein Arzt oder Zahnarzt ist, muss er die Aufklärung durchführen und die Einwilligung des Prüfungsteilnehmers einholen (gemäß § 28 Abs. 2 MPDG).
- Teilnahme an vom Sponsor organisierten Prüfertreffen.
- Sicherstellung der Genauigkeit, Zuordnung, Vollständigkeit, Lesbarkeit und Aktualität der Quelldaten sowie der an den Sponsor übermittelten Daten in den CRFs (Case Report Forms) und allen geforderten Berichten.
- Bei Prüfungsteilnehmern, die die Studienteilnahme beenden, um Erlaubnis ersuchen, Nachbeobachtungsdaten über deren Zustand bzw. deren Erkrankung erfassen zu dürfen.
- Bewertung unerwünschter Ereignisse (AE), insbesondere in Bezug auf den Schweregrad und den Zusammenhang mit dem Prüfprodukt.
- Im Falle von Umständen, die die Sicherheit der Prüfungsteilnehmer, Anwender oder Dritter beeinträchtigen können, sind unverzüglich alle erforderlichen Sicherheitsmaßnahmen zu ergreifen, um unmittelbare oder mittelbare Gefahr abzuwenden (gemäß § 66 Abs. 1 MPDG).
- Wenn es in der Prüfstelle nur einen Prüfer gibt, übernimmt dieser automatisch die Aufgaben des Hauptprüfers.
Die Verantwortlichkeiten des Prüfers sind umfangreich und vielseitig, wobei jeder Schritt dazu beiträgt, die Sicherheit der Patienten und die Integrität der klinischen Prüfung zu gewährleisten. Es ist daher essentiell,, dass Prüfer umfassend geschult sind und alle relevanten Regularien und Anforderungen kennen und verstehen.
2.3 Unabhängigkeit des Prüfers
Es ist von zentraler Bedeutung, dass der Prüfer unabhängig ist. Er darf weder vom Sponsor beeinflusst werden noch andere an der Prüfung beteiligte Personen oder Institutionen beeinflussen.
2.4 Kommunikation mit dem Sponsor
Der Prüfer sollte alle notwendigen Informationen vom Sponsor erhalten, um eine einheitliche Bewertung und Dokumentation der während der Prüfung gewonnenen Befunde zu gewährleisten.
3. Rolle des Sponsors
3.1 Definition und Verantwortung
Der Sponsor ist für die Initiierung, das Management und die Finanzierung der klinischen Prüfung verantwortlich. Er muss in der Europäischen Union ansässig sein oder einen in der EU ansässigen rechtlichen Vertreter benennen. Dieser Vertreter übernimmt die Verantwortung für die Einhaltung der Verpflichtungen des Sponsors und ist der Ansprechpartner für die Behörden und die Ethik-Kommission.
3.2 Aufgaben des Sponsors
Die ISO 14155 definiert eine Vielzahl von Aufgaben für den Sponsor, darunter:
- Planung und Vorbereitung der klinischen Prüfung: Dies umfasst unter anderem die Feststellung des Bedarfs für die klinische Prüfung, Risikomanagement, Konzepterstellung und Auswahl des klinischen Personals.
- Durchführung der klinischen Prüfung: Hierzu gehört die Sicherstellung der Einhaltung des Prüfplans, das Monitoring, Datenqualität und der Schutz personenbezogener Daten.
- Bewertung der Sicherheit: Der Sponsor muss alle unerwünschten Ereignisse erfassen, bewerten und dokumentieren.
- Beendigung der klinischen Prüfung: Dazu gehört auch die Kommunikation mit den Behörden und ggf. die Unterbrechung oder der Abbruch der Prüfung.
Hier spielt insbesondere der zweite Punkt, die Durchführung der klinischen Prüfung, eine entscheidende Rolle. Um diese sicherzustellen, sollten folgende Maßnahmen berücksichtigt werden:
Bereits im Vorfeld, vor dem Start am Prüfzentrum:
- Auswahl des richtigen Prüfzentrums: Das Prüfzentrum sollte über die erforderlichen Einrichtungen und Ressourcen verfügen und im besten Fall bereits Erfahrungen mit klinischen Prüfungen haben.
- Schulung des Prüfzentrums: Das Zentrum sollte über die aktuellen Anforderungen und Vorgaben sowie gesetzlichen Grundlagen informiert sein und diesbezüglich regelmäßig geschult worden sein.
- Überprüfung der Qualifikationen: Es sollte sichergestellt werden, dass der Prüfer oder zumindest der Hauptprüfer in einem Zentrum mit mehreren Prüfern eine aktuelle GCP-MDR-Schulung hat.
- Qualifikation des Studienteams: Das Team, das die Studie durchführt, insbesondere die Studienassistenz (Study Nurses), sollte ordentlich qualifiziert und geschult sein. Regelmäßige Fortbildungen können helfen, das Wissen auf dem neuesten Stand zu halten.
- Vorbereitende Audits: Vor Beginn der Studie können unabhängige Audits durchgeführt werden, um die Einhaltung der GCP-Richtlinien zu überprüfen.
- Klare Kommunikationswege: Vor Studienbeginn sollten klare Kommunikations- und Berichterstattungsverfahren etabliert werden.
Während der Studie:
- Regelmäßige Überwachung: Während der Studiendurchführung sollte das Prüfzentrum regelmäßig überwacht werden, um sicherzustellen, dass die Studienprotokolle ordnungsgemäß eingehalten werden. Dies geschieht über das Monitoring, das ebenfalls in der ISO 14155 festgeschrieben ist.
- Interne Audits: Das Prüfzentrum kann interne Audits durchführen, um die Einhaltung der Studienrichtlinien und -verfahren selbst sicherzustellen. Aber auch der Sponsor kann zur Sicherstellung der korrekten Durchführung ein Audit vor Ort durchführen.
- Dokumentationsanforderungen: Alle relevanten Dokumente sollten korrekt und zeitnah erfasst und archiviert werden.
- Kontinuierliche Schulung: Bei Änderungen in den Vorschriften oder im Studienprotokoll sollte das gesamte Studienteam erneut geschult werden.
Nach der Studie:
- Close-out Visit: Nach Abschluss der Studie wird der Abschlusstermin beim Monitoring gemäß ISO 14155 durchgeführt, um die Einhaltung aller Anforderungen sowie die korrekte Durchführung vor Ort zu überprüfen.
- Feedback-Schleife: Fehler oder Probleme, die während der Studie aufgetreten sind, sollten analysiert und in zukünftige Schulungen und Prozesse integriert werden.
Durch die Befolgung dieser Schritte kann die ordnungsgemäße Durchführung klinischer Studien in einem Prüfzentrum sichergestellt werden.
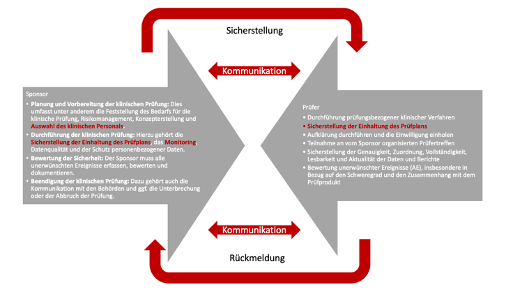
Abbildung: Interaktion Sponsor - Prüfer
4. Schlussfolgerung
Zusammenfassend ist festzustellen, dass sowohl der Prüfer als auch der Sponsor zentrale Rollen in klinischen Prüfungen gemäß ISO 14155 einnehmen. Ihre jeweiligen Aufgaben und Verantwortlichkeiten sind klar definiert, um die Integrität und Qualität der klinischen Prüfungen sicherzustellen. Es ist von immenser Bedeutung, dass beide Parteien ihre Rollen korrekt und gewissenhaft ausführen, um die Sicherheit und Wirksamkeit von Medizinprodukten für Patienten zu gewährleisten. Insbesondere im Vorfeld einer Studie kann durch gezielte Vorbereitung und Planung viel zur erfolgreichen Durchführung beigetragen werden. Dies umfasst unter anderem eine umfassende Schulung des Prüfzentrums um sicherzustellen, dass nicht nur der Prüfer, sondern das gesamte Studienteam gemäß GCP-MDR geschult sind. Die frühzeitige Identifizierung und Qualifikation von Study Nurses und anderen Schlüsselpersonen im Prüfzentrum kann auch entscheidend dazu beitragen, mögliche Hindernisse oder Verzögerungen während der Studie zu minimieren. Darüber hinaus sollte bereits im Vorfeld eine klare Kommunikationsstrategie zwischen Sponsor und Prüfzentrum etabliert werden, um Missverständnisse und potenzielle Fehlerquellen von Anfang an zu vermeiden. In Anbetracht der hohen Anforderungen und der enormen Verantwortung, die klinische Prüfungen mit sich bringen, ist eine proaktive, gut durchdachte Vorbereitung für den Erfolg unerlässlich. Es liegt in der gemeinsamen Verantwortung von Sponsor und Prüfer, sicherzustellen, dass alle Anforderungen und Standards nicht nur erfüllt, sondern konsequent umgesetzt werden.
5. Wie wir Ihnen helfen können
Ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss, klären wir bei medXteam im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Wenn eine klinische Prüfung durchgeführt werden soll, müssen zuvor grundlegende Sicherheits- und Leistungsanforderungen erfüllt sein. Die Daten aus der klinischen Prüfung münden dann in die klinische Bewertung, die wiederum die Basis für Post-Market-Clinical-Follow-up (PMCF)-Aktivitäten (einschließlich einer PMCF-Studie) darstellt.
Außerdem benötigen alle Hersteller von Medizinprodukten ein Qualitätsmanagement system (QMS), auch bei der Entwicklung von Produkten der Klasse I.
Wir unterstützen Sie während Ihres kompletten Vorhabens mit Ihrem Medizinprodukt, beginnend bei einer kostenlosen Erstberatung, Hilfe bei der Einführung eines QM Systems, Studienplanung und Durchführung bis hin zur Technischen Dokumentation - immer mit primärem Bezug auf die klinischen Daten zum Produkt: von Anfang an bis zum Ende.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung
