Wie wird eine klinische Bewertung basierend auf Leistungsdaten erstellt?
Abkürzungen
MDR Medical Device Regulation; EU-Verordnung 2017/745
PMCF Post-Market Clinical Follow-up, klinische Nachbeobachtung
CEP Clinical Evaluation Plan
CDP Clinical Development Plan
Zugrundeliegende Regularien
EU-Verordnung 2017/745 (MDR)
1. Einleitung
Wie bereits im letzten Blogbeitrag beschrieben, bildet die klinische Bewertung für sämtliche Medizinprodukte - von Klasse I bis Klasse III - einen essenziellen Schritt für jeden Hersteller von Medizinprodukten. Das leitet sich aus Artikel 61 der EU-Verordnung 2017/745 (MDR) ab:
„Der Hersteller legt den Umfang des klinischen Nachweises fest und begründet ihn, um die Erfüllung der relevanten grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen. Der Umfang des klinischen Nachweises muss den Merkmalen des Produkts und dessen Zweckbestimmung angemessen sein. Zu diesem Zweck führen Hersteller eine klinische Bewertung gemäß diesem Artikel und Anhang XIV Teil A durch, planen und dokumentieren diese.“
Wenn nun während der Planung im CEP die Route „Leistungsdaten“ festgelegt wurde, sind dennoch alle Anforderungen an den Prozess und an die Erstellung der klinischen Bewertung, die sich aus der MDR und auch noch aus der MEDDEV 2.7/1 Rev. 4 ergeben, einzuhalten. Wie das funktioniert: Darauf gibt nun dieser Blog-Beitrag die entsprechenden Antworten.
2. Die Route über Leistungsdaten
Der Weg, die klinische Leistung eines Produkts über Leistungsdaten nachzuweisen, war schon immer möglich und bleibt es auch weiterhin unter der MDR (Artikel 61):
„Wird der Nachweis der Übereinstimmung mit grundlegenden Sicherheits- und Leistungsanforderungen auf der Grundlage klinischer Daten für ungeeignet erachtet, ist jede solche Ausnahme auf der Grundlage des Risikomanagements des Herstellers und unter Berücksichtigung der besonderen Merkmale des Zusammenspiels zwischen dem Produkt und dem menschlichen Körper, der bezweckten klinischen Leistung und der Angaben des Herstellers angemessen zu begründen; dies gilt unbeschadet des Absatzes 4. In diesem Fall muss der Hersteller in der technischen Dokumentation gemäß Anhang II gebührend begründen, warum er den Nachweis der Übereinstimmung mit grundlegenden Sicherheits- und Leistungsanforderungen allein auf der Grundlage der Ergebnisse nichtklinischer Testmethoden, einschließlich Leistungsbewertung, technischer Prüfung („bench testing“) und vorklinischer Bewertung, für geeignet hält.“
Die Entscheidung stützt sich auf verschiedene Aspekte:
- das Resultat des Risikomanagements
- die Eigenschaften der Interaktion zwischen Produkt und Körper
- der Beleg für die Leistung basierend auf Produktevaluierungen (technisch, in-vitro)
- das Resultat der vorklinischen Bewertung (anfängliche Literaturrecherche, Verifizierungstests etc.)
Diese Entscheidung muss im Plan für die klinische Bewertung angemessen erklärt und dokumentiert werden.
Diese Route wird bevorzugt, wenn eine klinische Prüfung wenig Vorteil bietet. Ein typisches Beispiel dafür ist der Holzmundspatel, für den klinische Daten in der Literatur nicht existieren. In solchen Fällen zeigen technische Daten wie Bruchfestigkeit und Verarbeitung die Sicherheit und Leistungsfähigkeit des Produkts an.
Mit der immer weniger möglichen und anwendbaren Äquivalenzroute entwickelt sich diese basierend auf Leistungsdaten immer mehr zum neuen Standard, wenn nicht eigene klinische Daten generiert werden müssen.
Im Folgenden nun Beispiele, wann diese Route durchaus Sinn macht:
2.1 Beispiel – Medizinische Software
Die meisten Software-Produkte (Klasse I und IIa) sind Beispiele für Produkte, bei denen der Weg über Leistungsdaten sinnvoll ist. Die Begründung für diese Entscheidung ist wie folgt:
Das Produkt wurde im Rahmen des Software-Lebenszyklusprozesses gemäß IEC 62304 umfassend verifiziert, und alle Tests wurden erfolgreich abgeschlossen. Die Tests umfassten Unit-Tests, Integrationstests, Systemtests und Usability-Tests. Basierend auf diesen Tests kann gezeigt werden, dass das Produkt effektiv funktioniert.
Gemäß MDCG-2020-1 (Guidance on Clinical Evaluation (MDR)/Performance Evaluation (IVDR) of Medical Device Software) wird die wissenschaftliche Validität als das Ausmaß definiert, in dem der Output des Software-Produkts auf der Grundlage der ausgewählten Inputs und Algorithmen mit dem angestrebten physiologischen Zustand oder der klinischen Erkrankung assoziiert ist. Um den Nachweis der wissenschaftlichen Validität zu erbringen, wird eine Literatursuche durchgeführt, die auch den Nachweis des Nutzens gemäß der MDR sowie die Ermittlung des State-of-the-Arts und die Identifizierung der Sicherheit und Leistungsfähigkeit des Medizinprodukts beinhaltet.
Die klinisch relevanten Komponenten des Systems sind die Implementierungen der Algorithmen/Fragebögen zur Diagnose oder zum Therapieverlauf. Die Literaturrecherche konzentriert sich auf Scores/Erkennungsalgorithmen sowie auf den allgemeinen Einsatz digitaler Produkte in der Diagnose/Therapie der genannten Indikationen.
Tabelle 1: Klinische Bewertung eines Softwareproduktes
2.2 Beispiel – Zahnarztstuhl
Ein weiteres Produkt, dessen klinische Leistung, Sicherheit und Nutzen gut über Leistungsdaten bewertet werden können und für das eine klinische Prüfung keinen Sinn ergibt, ist die dentale Behandlungseinheit: der Zahnarztstuhl.
Solche Produkte sind aktive Medizinprodukte, die zur Behandlung von Kindern und Erwachsenen im zahnmedizinischen Bereich dienen. Diese Produkte sind zahnärztliche Behandlungsgeräte nach ISO 7494 mit einem zahnärztlichen Patientenstuhl nach ISO 6875. Sie sind ausschließlich für den Einsatz in der Zahnheilkunde vorgesehen und dürfen nur von medizinischem Fachpersonal bedient werden. Die dentale Behandlungseinheit wird als Hilfsmittel zur Patientenlagerung und zur Behandlung im dentalmedizinischen Bereich eingesetzt. Abhängig davon, ob Dentalinstrumente Teil dieser Behandlungseinheit sind und wenn ja, welche, werden diese Produkte in die Klasse IIa oder IIb eingestuft.
Aufgrund der klaren Zweckbestimmung dieser Produkte erübrigt sich die Frage, ob eine klinische Prüfung am Menschen durchgeführt werden soll. Die Behauptungen zum Produkt beziehen sich auf die Ergonomie sowohl für den Patienten als auch für den Behandler und Anwender des Produkts. Außerdem wird ein effizientes und einfaches Arbeiten hervorgehoben, und vorgeschriebene Verfahren sowie unterstützende Komponenten dienen der Erleichterung der Infektionskontrolle und der Aufrechterhaltung der Wasserqualität. Diese Aussagen sind keine geeigneten Endpunkte für eine klinische Prüfung. Sie können jedoch mit Leistungsdaten belegt werden. Zum Beispiel kann das Thema Ergonomie und einfache Anwendung über den Test zur Gebrauchstauglichkeit (DIN EN 62366-1) belegt werden. Die Einhaltung der jeweiligen Normen und Vorschriften zur Wasserhygiene und -qualität bestätigt ebenfalls diese Behauptungen zum Produkt. Die Begründung für die Wahl des Weges über Leistungsdaten ist hier nun in Tabelle 2 aufgeführt:
Tabelle 2: Klinische Bewertung eines aktiven Produkts
2.3 Beispiel – Herzrhythmus Detektor
Ein weiteres Beispiel ist ein Klasse IIa-Produkt, das Episoden von unregelmäßigem Herzrhythmus, die auf Vorhofflimmern hinweisen, durch Langzeitüberwachung der Pulsparameter über mehrere Tage bis zu vier Wochen erkennen kann. Es unterstützt somit die Diagnose, indem es Hinweise auf Vorhofflimmern liefert.
Diesem Produkt liegt eine eingebettete Software zugrunde, über deren Algorithmus die Episoden erkannt und entsprechend angezeigt werden. Die Verifizierung und Validierung der Software liefert bereits entscheidende Daten zur Funktionsweise dieses Medizinprodukts. Trotz der Möglichkeit, eine klinische Prüfung am Menschen durchzuführen, müssen auch ethische Bedenken berücksichtigt werden. Eine Ethikkommission prüft genau diese Aspekte. Es gibt jedoch alternative Wege, um klinische Daten zur Erfüllung der klinischen Leistung und Funktion des Produkts zu generieren. Beispielsweise können Episoden über Simulationstests eingespielt werden, um zu überprüfen, ob der Algorithmus sie korrekt erkennt. Auch hier bedarf es keiner Humanstudie, um diesen Nachweis zu erbringen. Die Begründung für diese Route ist in der folgenden Tabelle aufgeführt:
Tabelle 3: Klinische Bewertung Herzrhythmus-Detektor
2.4 Beispiel – Dentalimplantat
Selbst mit einem implantierbaren Produkt kann dies ein gangbarer Weg sein, wie unser letztes Beispiel aus der Zahntechnik zeigt: Die Titanbasis ist ein Teil eines Dentalimplantats, ein implantierbares Medizinprodukt der Klasse IIb. Die Titanbasis dient der Herstellung eines individuell angefertigten implantatprothetischen Aufbaus. Sie stellt nach dem Verkleben mit einem CAD/CAM gefrästen Aufbau das Verbindungselement zum Implantat dar. Sie kann auch einzeln vertrieben werden, sodass auch für dieses Produkt eine klinische Bewertung erstellt werden muss.
Bei der Durchführung einer Literatursuche im Bereich der Dentalimplantate stößt man schnell auf die Grenzen solcher Systemkomponenten. Denn es gibt noch keine Humanstudie, die ausschließlich die Titanbasis als Prüfprodukt untersucht hat. Publiziert wurden lediglich In-vitro-Studien oder Studien zu Materialeigenschaften (Titan) usw. Wie die Wahl der Route über Leistungsdaten in diesem Fall begründet wird, ist in Tabelle 4 aufgeführt:

Tabelle 4: Klinische Bewertung Titanbasis
3. Aufbau und Struktur einer klinischen Bewertung basierend auf Leistungsdaten
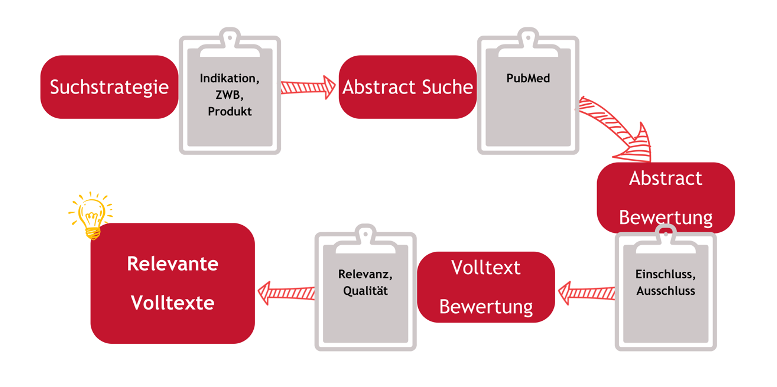
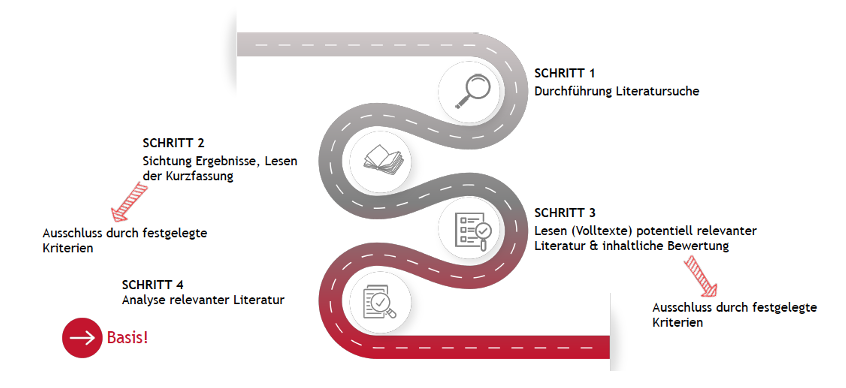
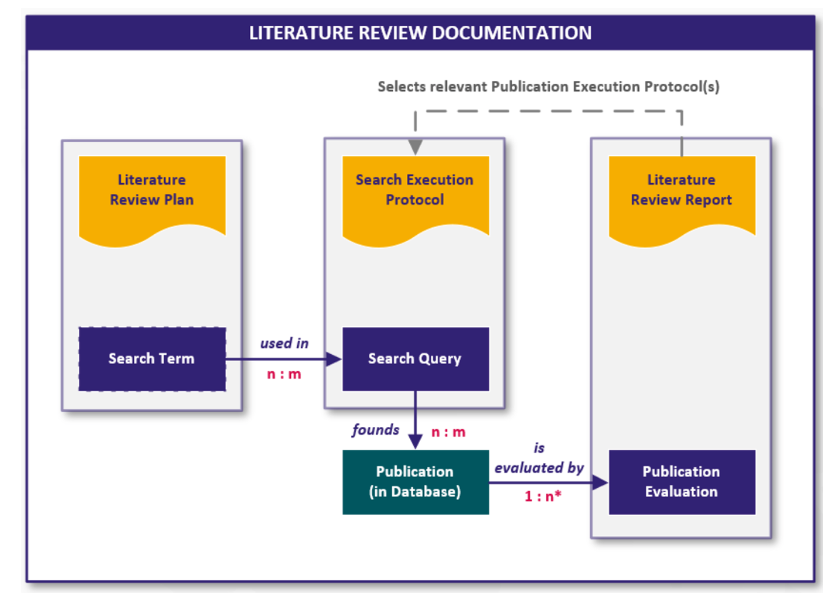
Eine klinische Bewertung basierend auf Leistungsdaten hat im Wesentlichen dieselbe Struktur und den gleichen Aufbau wie eine herkömmliche klinische Bewertung der anderen beiden Routen. Sie beinhaltet deshalb auch die Durchführung einer Literatursuche.
Der Unterschied besteht darin, dass es einen umfangreicheren Abschnitt zu vorhandenen Leistungs-/Verifizierungsdaten gibt und einen Abschnitt zur Begründung gemäß Art. 61 (10) der MDR. Dies bedeutet, dass diese Route auf der Grundlage des Risikomanagements des Herstellers und unter Berücksichtigung der besonderen Merkmale des Zusammenspiels zwischen dem Produkt und dem menschlichen Körper, der bezweckten klinischen Leistung und der Angaben des Herstellers angemessen zu begründen ist. Dies wird in Form der obigen Beispiele in einem speziellen Abschnitt der klinischen Bewertung dokumentiert.
4. Vorgehen bei dieser Route basierend auf Leistungsdaten
Eine klinische Bewertung basierend auf Leistungsdaten beginnt also konsequenterweise zunächst mit einer ausführlichen Betrachtung der präklinischen Daten, auch Verifizierungs- oder Leistungsdaten genannt.
Diese Daten bilden bei dieser Route die Datenbasis und liefern wichtige Informationen über die Sicherheit und Leistungsfähigkeit des Medizinprodukts. Das ist der Gegenstand der weiteren Bewertung.
4.1 Messbare Parameter
Bei der Erstellung einer klinischen Bewertung basierend auf Leistungsdaten ist deshalb genauso wichtig wie bei den anderen Routen, eine Liste von Claims zum Produkt zu erstellen, insbesondere in Bezug auf die Leistung:
Damit ist eine „nichterschöpfende Liste und Spezifizierung der Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen und die Zweckbestimmung bzw. Zweckbestimmungen des Produkts“ gemeint. (Anhang XIV, Teil A, 1(a) der MDR)
Diese Claims sollten somit messbare Parameter enthalten, die sich hauptsächlich aus den Leistungsdaten ableiten. Wie bereits erwähnt, geben diese Daten wichtige Aufschlüsse über die Sicherheit und Wirksamkeit des Medizinprodukts und sind die Basis für die weitere Beurteilung. Diese Daten sind zu dokumentieren, zu analysieren und dann gründlich auszuwerten.
Der Nachweis der messbaren Parameter ist ein wichtiger Bestandteil der klinischen Bewertung eines Medizinprodukts. Er resultiert aus klinischen Daten im State-of-the-Art-Teil der klinischen Bewertung sowie den Verifizierungs-/Leistungsdaten zum Produkt. Diese Daten bilden die Basis für die Beurteilung der Sicherheit und Leistungsfähigkeit des Produkts. Durch die sorgfältige Analyse und Bewertung dieser Daten können fundierte Schlussfolgerungen über die klinische Leistung und Sicherheit des Produkts gezogen werden.
4.2 Ähnliche Produkte
Bei der Erstellung einer klinischen Bewertung basierend auf Leistungsdaten spielt die Berücksichtigung ähnlicher Produkte eine wichtige Rolle. Der Hersteller sollte eine Liste ähnlicher Produkte erstellen und prüfen, ob klinische Daten für diese Produkte verfügbar sind. Diese Daten können relevante Informationen zur Sicherheit und Leistung des zu bewertenden Geräts liefern. Es ist wichtig, dass der Hersteller eine angemessene Suche in der wissenschaftlichen Literatur, in diesem Fall im Rahmen der State-of-the-Art-Literatursuche (s. unten), durchführt, um sicherzustellen, dass alle relevanten Daten berücksichtigt werden.
Wenn klinische Daten für ähnliche Produkte verfügbar sind, sollten diese in die klinische Bewertung aufgenommen und bewertet werden. Diese Daten können insbesondere für die Überwachung nach dem Inverkehrbringen / PMCF-Planung von Bedeutung sein (MDCG 2020-13)
4.3 Literatursuche
Auch bei der Erstellung einer klinischen Bewertung basierend auf Leistungsdaten spielt die Literatursuche eine wesentliche und wichtige Rolle:
Der Schwerpunkt sollte hier auf dem State of the Art liegen, wobei Daten zu ähnlichen oder Benchmark-Produkten, alternativen Anwendungen und Outcomes sowie messbare Parameter berücksichtigt werden sollten.
Wie bereits erwähnt, ist eine Liste von Claims zum Produkt zu erstellen, insbesondere in Bezug auf die Leistung, die messbare Parameter enthält, die sich hauptsächlich aus den Leistungsdaten ableiten.
Auf Grundlage der erstellten Liste der ähnlichen Produkte wird im Rahmen der Literatursuche geprüft, ob klinische Daten für diese Produkte verfügbar sind. Hierzu ist eine angemessene Suche in der wissenschaftlichen Literatur durchzuführen, um sicherzustellen, dass alle relevanten Daten berücksichtigt werden.
In der Regel gibt es keine oder nur wenige Daten zum Produkt, deshalb spielen bei dieser Route State-of-the-Art-Daten die größte Rolle. Diese beziehen sich neben möglichen Daten zu ähnlichen Produkten auch auf alternative Anwendungen und deren Outcomes auch wieder in Bezug auf die messbaren Parameter.
Daraus lassen sich dann eben nicht nur messbare Parameter ableiten, sondern es können auch auch die Ergebnisse zum Produkt diskutiert werden basierend auf den Leistungsdaten in Bezug auf die messbaren Parameter im Abgleich mit dem State of the Art.
Eine gründliche Literatursuche, die sich auf State-of-the-Art-Daten konzentriert, kann somit dazu beitragen, die Sicherheit und Leistung des Produkts im Kontext der aktuellen wissenschaftlichen Erkenntnisse zu bewerten. Dies kann durch den Vergleich der Leistungsdaten des Produkts mit den Daten ähnlicher oder Benchmark-Produkte sowie durch die Berücksichtigung alternativer Anwendungen und deren Outcomes erreicht werden.
Es ist wichtig, dass dabei eine angemessene Suche in der wissenschaftlichen Literatur durchgeführt wird, um sicherzustellen, dass alle relevanten Daten berücksichtigt werden. Die Ergebnisse der Literatursuche sollten sorgfältig dokumentiert und analysiert werden, um fundiert die Sicherheit und Leistung des Produkts im Vergleich zum State of the Art zu diskutieren und um angemessene Schlussfolgerungen daraus ziehen zu können.
5. Schlussfolgerung
Die Route über Leistungsdaten wird immer mehr zum Standard neben der klinischen Bewertung mit eigenen klinischen Daten. Der Schwerpunkt liegt hier auf den Leistungsdaten und es müssen messbare Parameter definiert werden, die sich hauptsächlich aus den Leistungsdaten ableiten. Diese Daten sind wichtig, um die Sicherheit und Leistungsfähigkeit des Medizinprodukts zu beurteilen. Die Grundlage bildet auch hier eine umfassende Literatursuche, allerdings mit Schwerpunkt auf State of the Art, ähnliche Produkte und Anwendungen.
Eine gründliche Literatursuche, die sich auf State-of-the-Art-Daten konzentriert, kann somit dazu beitragen, die Sicherheit und Leistung des Produkts im Kontext der aktuellen wissenschaftlichen Erkenntnisse zu bewerten. Dies kann durch den Vergleich der Leistungsdaten des Produkts mit den Daten ähnlicher oder Benchmark-Produkte sowie durch die Berücksichtigung alternativer Anwendungen und deren Outcomes erreicht werden.
Dabei ist es wichtig, dass eine angemessene Suche in der wissenschaftlichen Literatur durchgeführt wird, um sicherzustellen, dass alle relevanten Daten berücksichtigt werden. Die Ergebnisse der Literatursuche sollten sorgfältig dokumentiert und analysiert werden, um fundiert die Sicherheit und Leistung des Produkts im Vergleich zum State of the Art zu diskutieren und um angemessene Schlussfolgerungen daraus ziehen zu können.
Dann resultiert auch bei dieser Route eine in sich stimmige und schlüssige klinische Bewertung gemäß den MDR-Anforderungen.
6. Wie wir Ihnen helfen können
Als CRO unterstützen wir Sie über den gesamten Prozess der Generierung und Bewertung klinischer Daten und bei der Zulassung und Marktüberwachung Ihres Produkts. Und dabei beginnen wir mit der klinischen Strategie! Außerdem erstellen wir die komplette klinische Bewertungsakte für Sie.
Im Falle von klinischen Prüfungen überlegen wir gemeinsam mit Ihnen, ob überhaupt und wenn ja welche klinische Prüfung unter welchen Voraussetzungen und gemäß welchen Anforderungen durchgeführt werden muss. Das klären wir im Rahmen der Pre-Study Phase: In 3 Schritten ermitteln wir die richtige und kosteneffiziente Strategie in Bezug auf die in Ihrem Fall erforderliche klinische Datenerhebung.
Wenn eine klinische Prüfung durchgeführt werden soll, müssen zuvor grundlegende Sicherheits- und Leistungsanforderungen erfüllt sein. Die Daten aus der klinischen Prüfung münden dann in die klinische Bewertung, die wiederum die Basis für Post-Market-Clinical-Follow-up (PMCF)-Aktivitäten (ggf. einschließlich einer PMCF-Studie) darstellt.
Außerdem benötigen alle Hersteller von Medizinprodukten ein Qualitätsmanagement system (QMS), auch bei der Entwicklung von Produkten der Klasse I.
Wir unterstützen Sie während Ihres kompletten Vorhabens mit Ihrem Medizinprodukt, beginnend bei einer kostenlosen Erstberatung, Hilfe bei der Einführung eines QM Systems, Studienplanung und Durchführung bis hin zur Technischen Dokumentation - immer mit primärem Bezug auf die klinischen Daten zum Produkt: von Anfang an bis zum Ende.
Haben Sie jetzt schon erste Fragen?
Eine kostenfreie Erstberatung erhalten Sie hier: kostenlose Erstberatung